Confocal à balayage laser

Principe du Confocal LSM
En microscopie classique à épi-fluorescence, un des problèmes majeurs est la présence d’un bruit de fond important lié à l’épaisseur de l’objet observé. Bien que la mise au point se fasse sur un plan focal précis, l’enregistrement de l’information est entaché d’un bruit de fond qui se superpose à l’image du plan observée : ce bruit résulte de l’excitation, par la source lumineuse, de tous les fluorochromes situés sur le trajet lumineux. Le microscope confocal agit comme un microtome optique, son principe consiste à focaliser, par l’intermédiaire d’un objectif, un faisceau laser qui va exciter les fluorochromes en un point de l’échantillon, puis à récupérer, sur un photomultiplicateur, le signal lumineux émis en ce point. Un diaphragme (pinhole) qui arrête tout signal ne provenant pas du plan focal est placé devant le photomultiplicateur. Le signal reçu est amplifié dans le photomultiplicateur, traité afin d’améliorer le rapport signal sur bruit, puis numérisé. L’image est construite point à point par balayage (X,Y) du champ analysé à l’aide de miroirs de déflection de la source lumineuse. Une platine motorisée déplace la préparation suivant l’axe Z permettant la saisie de différents plans optiques dans l’épaisseur de l’objet. Les images ainsi formées sont stockées sur la mémoire d’un ordinateur.
Rôle du pinhole
Le diaphragme de détection joue un rôle essentiel dans la résolution spatiale : il s’agit d’un diaphragme à iris permettant d’ajuster le volume élémentaire analysé par la sonde lumineuse. La résolution spatiale maximum est obtenue, outre les conditions d’optique classique (longueur d’onde, ouverture numérique de l’objectif), par l’ajustement du diamètre du pinhole à la limite de diffraction c’est à dire égal à la tache d’Airy.
Avantages
Le microscope confocal possède de nombreux avantages par rapport à la microscopie conventionnelle. Tout d’abord la faible profondeur de champ (0,5 – 1,5 µm) du microscope permet d’obtenir une image d’un plan focal (coupe optique) avec une définition bien supérieure au microscope conventionnel et par conséquence le bruit de fluorescence continu est pratiquement éliminé. Il en résulte une très bonne sensibilité de détection, une augmentation du contraste et une “clarification” des images. Un autre avantage du microscope confocal est que l’on peut obtenir des coupes optiques non seulement dans le plan XY mais également suivant un plan parallèle à l’axe optique (plan XZ) qui peuvent faire l’objet de reconstructions tridimensionnelles. Ces coupes optiques n’affectent en rien l’intégrité de l’échantillon biologique contrairement aux coupes physiques nécessaires en microscopie photonique et électronique. En outre, l’acquisition numérisée des images permet sur station de traitement d’images, d’accroître les possibilités d’analyse et de quantification.
Microscopie confocale et cytométrie subcellulaire
L’acquisition séquentielle de plusieurs canaux de fluorescence sur un ensemble de coupes optiques sériées permet de détecter la fréquence de coïncidences spatiales ainsi que les zones d’exclusion des deux marqueurs immunocytochimiques considérés.
La superposition de deux ensembles de coupes ainsi que la construction de cytofluogrammes de visualisation pour chaque plan de coupe permet de repérer et d’estimer quantitativement la co-localisation entre deux marqueurs.
Analyse spectrale
Le but de l’analyse spectrale est de détecter les différentes longueurs d’onde de la lumière émise par l’échantillon.
Dans les confocaux Leica, la lumière émise par l’échantillon est diffractée par un prisme. La lumière passe ensuite par une fente, et est collectée par un photomultiplicateur. En se déplaçant, la fente « balaie » ainsi la gamme de longueur d’onde voulue.
Dans les confocaux Zeiss, la lumière émise est difractée par un réseau et est envoyée sur 32 petits photomultiplicateurs qui détectent chacun une gamme de longueur d’onde.
Dans les confocaux Olympus, la lumière est diffractée par un réseau et les longueurs d’ondes sont sélectionnées devant le photomultiplicateur grâce à une fente.
L’analyse spectrale permet la séparation de fluorochromes qui présentent une grande superposition de leurs spectres d’émission (par exemple, séparation CFP/YFP/GFP) ainsi que la détermination de la présence d’autofluorescence dans l’échantillon.
L’enregistrement, l’analyse et la séparation spectrale est réalisée en 3 étapes :
1. Acquisition d’un lambda stack (série d’images représentant l’intensité du/des fluorochrome(s) en fonction de la longueur d’onde émise)
2. Comparaison avec un spectre de référence
3. Déconvolution spectrale
Etude de dynamique
La système de scan de l’échantillon grâce à des miroirs galvanométriques permet des étude de dynamiques moléculaires par photoblanchiement, photoactivation ou photoconversion d’une zone d’intérêts.
Equipement Confocal LSM
- SP5 AOBS:
Observation de tranche optique en fluorescence, détection modulable, simple et simultanée jusqu’à cinq couleurs de 400nm à 750nm, transmission, contraste interférentiel de Nomarski (DIC).
Statif et platine piezo entièrement motorisés pour des acquisitions automatisées dans le temps, multi-position et mosaïque. Correction d’ombrage et alignement de mosaïque.
Incubateur contrôlant la température de 25 à 40°C et l’apport en CO2.
Scanner résonnants pour l’imagerie rapide
– Statif inversé et motorisé DMI6000 (Leica Microsystem)
– Confocal SP5 AOBS
– Excitation : Diode Laser 405nm (25mW); laser Argon 458nm, 476nm, 488nm (40mW) 496nm et 514nm; Diode laser 561nm (15mW); laser Hélium néon 633nm (10mW)
– 5 détecteurs pour la fluorescence : trois PMTs et deux HyD très sensibles
– 1 détecteur PMT en transmission et jeux de prismes pour des acquisitions en brightfield et contraste interférentiel de Nomarski (DIC)
– Scanner résonants activables pour des acquisitions rapides.
– Logiciel d’acquisiton LAS
– Enceinte contrôlée en température et CO2 (Life Imaging Service)
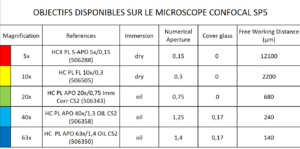
– Objectifs disponibles sur le microscope confocal SP5 :
- LSM780 spectral:
Observation de tranches optiques en fluorescence, détection spectrale de 400nm à 700nm permettant de séparer des spectres d’émission se chevauchant, transmission, contraste interférentiel de Nomarski (DIC).
Statif entièrement motorisés pour des acquisitions automatisées dans le temps, multi-position et mosaïque. Correction d’ombrage et alignement de mosaïque automatique. Système d’Autofocus intégré pour éliminer la dérive en Z. Incubateur contrôlant la température de 25 à 50°C et l’apport en CO2.
– Statif inversé et motorisé Axio Observer Z.1 (Zeiss)
– Autofocus harware (Definite Focus2)
– Excitation : Diode Laser raie à 405nm(30mW); Argon raies à 458, 476, 488 (25mW) 496 et 514nm; DPSS raie à 561nm(15mW); Hélium Néon raie à 633nm (5mW)
– 2 détecteurs PMTs pour la fluorescence
– 1 détecteur spectral GaAsP plus sensible pour des acquisitions spectrales en temps réel
– 1 détecteur PMT en transmission et jeux de prismes pour des acquisitions en brightfield et contraste interférentiel de Nomarski (DIC)
– Logiciel d’acquisition ZEN Black
– Enceinte contrôlée en température et CO2
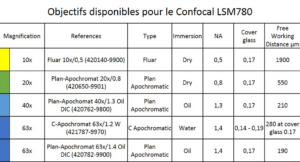
Objectifs disponibles sur le microscope confocal LSM780 :
- LSM980 spectral Airyscan 2 :
Observation de tranches optiques en fluorescence, détection spectrale de 400nm à 800nm permettant de séparer des spectres d’émission se chevauchant, transmission, contraste interférentiel de Nomarski (DIC).
Statif entièrement motorisés pour des acquisitions automatisées dans le temps, multi-position et mosaïque. Correction d’ombrage et alignement de mosaïque automatique. Système d’Autofocus intégré pour éliminer la dérive en Z. Incubateur contrôlant la température de 25 à 50°C et l’apport en CO2.
– Statif inversé et motorisé Axio Observer (Zeiss)
– Autofocus harware (Definite Focus2)
– Excitation : Diodes Laser raies 405nm ; 445nm ; 488nm ; 514nm ; 561nm ; 639nm
– 2 détecteurs PMTs pour la fluorescence
– 32 détecteurs GaAsP refroidis pour des acquisitions spectrales en temps réel
– 1 détecteur PMT en transmission et jeux de prismes pour des acquisitions en brightfield et contraste interférentiel de Nomarski (DIC)
– Module Airyscan 2 pour des acquisitons à haute résolution, plus rapides et plus sensibles (mode SR4Y, SR8Y, CO8Y)
– Logiciel d’acquisition ZEN 2.3 Blue edition
– Enceinte contrôlée en température et CO2
– Objectifs disponibles:
Plan-Apochromat 10x/0,3 DIC 420642-9800
LD LCI Plan-Apochromat 25x/0.8 Imm Corr DIC 420852-9870
Plan-Apochromat 40x/1.3 Oil DIC 420762- 9800
Plan-Apochromat 63x/1.4 Oil DIC 420782-9900

