Facteurs de transcription et destin cellulaire
Vanessa RIBES

Nos projets de recherche visent à mieux comprendre la plasticité et la stabilité des phénotypes cellulaires en analysant la génération de la diversité neuronale au sein de la moelle épinière embryonnaire et la transformation qui mène aux rhabdomyosarcomes, des cancers pédiatriques. Nous nous concentrons tout particulièrement sur les facteurs de transcription PAX dont l’activité modulaire est capable de générer une incroyable diversité des états cellulaires.
Mots-clés : différenciation cellulaire, facteurs de transcription, moelle épinière embryonnaire, Rhabdomyosarcomes, Spina Bifida, PAX, organoïdes, cellules souches pluripotentes
+33 (0)1 57 27 81 93 Contact @VanessaRibes https://ribeslab.wordpress.com/
Notre laboratoire étudie la mise en place de destinées cellulaires au travers de deux grands projets.
D’une part, nous explorons la manière dont émerge la diversité neuronale au sein de la moelle épinière embryonnaire. D’autre part, nous étudions les moyens par lesquels les réseaux géniques liés à l’activité des facteurs de transcription PAX contrôlent le remodelage des tissus. Ces projets ont tous deux des retombées pour la compréhension de pathologies infantiles que sont le rhabdomyosarcome et la spina bifida.
Nous abordons ces projets principalement à l’aide d’organoïdes de moelle épinière que nous générons à partir de cellules souches pluripotentes. Il s’agit de modèles récapitulant la physiologie des tissus, y compris humains, et d’une grande malléabilité, permettant notamment la mise en œuvre d’approches de génie génétique et de pharmacologie.
Patterning de la diversité neuronale :
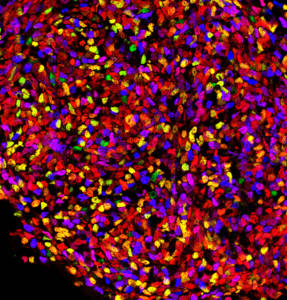
L’organisation stéréotypée de la diversité neuronale dans la moelle épinière est étonnante et est essentielle à la fonction des circuits moteurs et sensoriels. Des centaines de sous-types de neurones sont générés à un endroit précis le long des axes antéro-postérieur et dorso-ventral du tube neural. La correspondance entre les coordonnées des cellules et leur destin est assurée par l’action combinée de molécules de signalisation sécrétées, telles que les morphogènes Shh ou BMP, et de déterminants intrinsèques du destin cellulaire, notamment les facteurs de transcription PAX. Ensemble, ils sont responsables de la génération de patrons d’expression de gènes en bandes, organisées le long des axes orthogonaux du tube neural en développement.
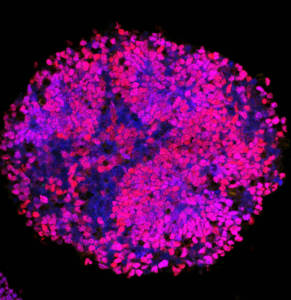
Nous nous intéressons à la manière dont ces bandes d’expression génique sont générées et à la façon dont elles sont traduites en des comportements et statuts cellulaires spécifiques. En particulier, nous accordons beaucoup d’attention à la modulation de l’activité transcriptionnelle des facteurs PAX qui sont à la fois capable d’activer et de réprimer l’expression de gènes. Cette bivalence étant régulée dans l’espace et le temps. Nous cherchons à savoir comment le pleiotropisme dans l’activité des PAX est généré et lu au niveau du génome et quels sont les partenaires et les domaines protéiques structurels qui soutiennent ce pleiotropisme.
Remodelage des tissus :
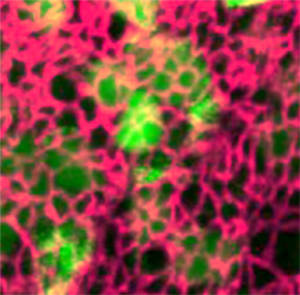
La dynamique de la forme des cellules au sein des épithéliums sous-tend la morphogenèse de nombreux organes. Il en est de même pour la formation de la moelle épinière qui s’accompagne d’importants remodelages de son épithélium pseudo-stratifié. Il s’agit notamment de la courbure et de la fusion de la plaque neurale caudale en un tube, de la transition épithélio-mésenchymateuse (EMT) des cellules de la crête neurale (NCC) situées dorsalement et de la délamination des neurones nés précocement.
Tous ces événements sont sous le contrôle de l’activité des protéines PAX3 et PAX7 et les perturbations de l’activité de PAX chez l’homme peuvent conduire à des conditions pathologiques. Parmi celles-ci, citons-le spina bifida, une maladie congénitale résultant d’un défaut de fermeture du tube neural, ou le comportement métastatique du rhabdomyosarcome. D’où notre intérêt à comprendre les moyens par lesquels l’activité des PAX et les réseaux de gènes associés sont capables de générer de la diversité dans la forme et les comportements des cellules épithéliales.
Membres
 Kenza CHERIET, Doctorante, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Kenza CHERIET, Doctorante, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B Claire DUGAST, Chercheur, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Claire DUGAST, Chercheur, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B Pascale GILARDI HEBENSTREIT, Chercheur, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Pascale GILARDI HEBENSTREIT, Chercheur, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B Marine GRISON, Ingénieure d études, RIBES LAB
Marine GRISON, Ingénieure d études, RIBES LAB Grace HENSTONE, Doctorante, RIBES LAB
Grace HENSTONE, Doctorante, RIBES LAB Theaud HEZEZ, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Theaud HEZEZ, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B Helena MALEK, Doctorante, RIBES LAB
Helena MALEK, Doctorante, RIBES LAB Camil MIRDASS, Doctorant, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Camil MIRDASS, Doctorant, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B Stephane NEDELEC, Chercheur, RIBES LAB
Stephane NEDELEC, Chercheur, RIBES LAB Robin RONDON, Doctorant, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Robin RONDON, Doctorant, RIBES LAB+33 (0)1 57 27 81 93, bureau 555B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
Dynamic extrinsic pacing of the HOX clock in human axial progenitors controls motor neuron subtype specification. Mouilleau V, Vaslin C, Robert R, Gribaudo S, Nicolas N, Jarrige M, Terray A, Lesueur L, Mathis MW, Croft G, Daynac M, Rouiller-Fabre V, Wichterle H, Ribes V, Martinat C, Nedelec S. Development. 2021 Mar 29;148(6):dev194514. doi: 10.1242/dev.194514.
The PAX-FOXO1s trigger fast trans-differentiation of chick embryonic neural cells into alveolar rhabdomyosarcoma with tissue invasive properties limited by S phase entry inhibition. Gonzalez Curto G, Der Vartanian A, Frarma YE, Manceau L, Baldi L, Prisco S, Elarouci N, Causeret F, Korenkov D, Rigolet M, Aurade F, De Reynies A, Contremoulins V, Relaix F, Faklaris O, Briscoe J, Gilardi-Hebenstreit P, Ribes V. PLoS Genet. 2020 Nov 11;16(11):e1009164. doi: 10.1371/journal.pgen.1009164.
Dullard-mediated Smad1/5/8 inhibition controls mouse cardiac neural crest cells condensation and outflow tract septation. Darrigrand JF, Valente M, Comai G, Martinez P, Petit M, Nishinakamura R, Osorio DS, Renault G, Marchiol C, Ribes V, Cadot B. Elife. 2020 Feb 27;9:e50325. doi: 10.7554/eLife.50325.
BMP4 patterns Smad activity and generates stereotyped cell fate organization in spinal organoids. Duval N, Vaslin C, Barata TC, Frarma Y, Contremoulins V, Baudin X, Nedelec S, Ribes VC. Development. 2019 Jul 25;146(14):dev175430. doi: 10.1242/dev.175430.
Pax3- and Pax7-mediated Dbx1 regulation orchestrates the patterning of intermediate spinal interneurons. Gard C, Gonzalez Curto G, Frarma YE, Chollet E, Duval N, Auzié V, Auradé F, Vigier L, Relaix F, Pierani A, Causeret F, Ribes V. Dev Biol. 2017 Dec 1;432(1):24-33. doi: 10.1016/j.ydbio.2017.06.014.
Structures and properties of PAX linked regulatory networks architecting and pacing the emergence of neuronal diversity. Curto GG, Gard C, Ribes V. Semin Cell Dev Biol. 2015 Aug;44:75-86. doi: 10.1016/j.semcdb.2015.09.010.
Distinct regulatory mechanisms act to establish and maintain Pax3 expression in the developing neural tube. Moore S, Ribes V, Terriente J, Wilkinson D, Relaix F, Briscoe J. PLoS Genet. 2013;9(10):e1003811. doi: 10.1371/journal.pgen.1003811.
Gene regulatory logic for reading the Sonic Hedgehog signaling gradient in the vertebrate neural tube. Balaskas N, Ribeiro A, Panovska J, Dessaud E, Sasai N, Page KM, Briscoe J, Ribes V. Cell. 2012 Jan 20;148(1-2):273-84. doi: 10.1016/j.cell.2011.10.047.
Publications
Revues
Line Manceau Thèse Soutenue le 24 Septembre 2021
“Etude des mécanismes moléculaires et cellulaires par lesquels les facteurs de transcription paralogues PAX3-FOXO1 et PAX7-FOXO1 exercent leur activité oncogénique”
- Stéphane Nedelec (Institut du Fer à Moulin,IFM, Paris)
- Marie Castets (Centre de Recherche en Cancérologie de Lyon, CRCL, Lyon)
- Valérie Dupé (Institut Génétique & Développement de Rennes, IGDR, Rennes)
- Eddy Pasquier (Centre de Recherche en Cancérologie de Marseille, CRCM, Marseille)
- Ligue Nationale contre le Cancer
- Programme “Enfants Adolescents Cancer 2020”
- Institut National du Cancer “High Risk High Gain 2020”
- WonderAugustine “Recherche & DIPG”
- ANR
24/09/2021 – Soutenance de thèse de Line MANCEAU

