Recherche
Les pores nucléaires (NPCs, nuclear pore complexes) sont des structures élaborées, ancrées dans l’enveloppe nucléaire et composées de copies multiples d’environ 30 protéines différentes appelées nucléoporines (Nups).
Nos travaux antérieurs ont contribué à la caractérisation d’un sous-complexe structural majeur des NPCs, le complexe Nup107-160 (aussi appelé « Y-complexe« , Figure 1), et à mettre en évidence son rôle dans l’assemblage des NPCs, sa contribution aux différentes étapes de la progression mitotique, et son implication dans la différenciation des cellules souches embryonnaires.
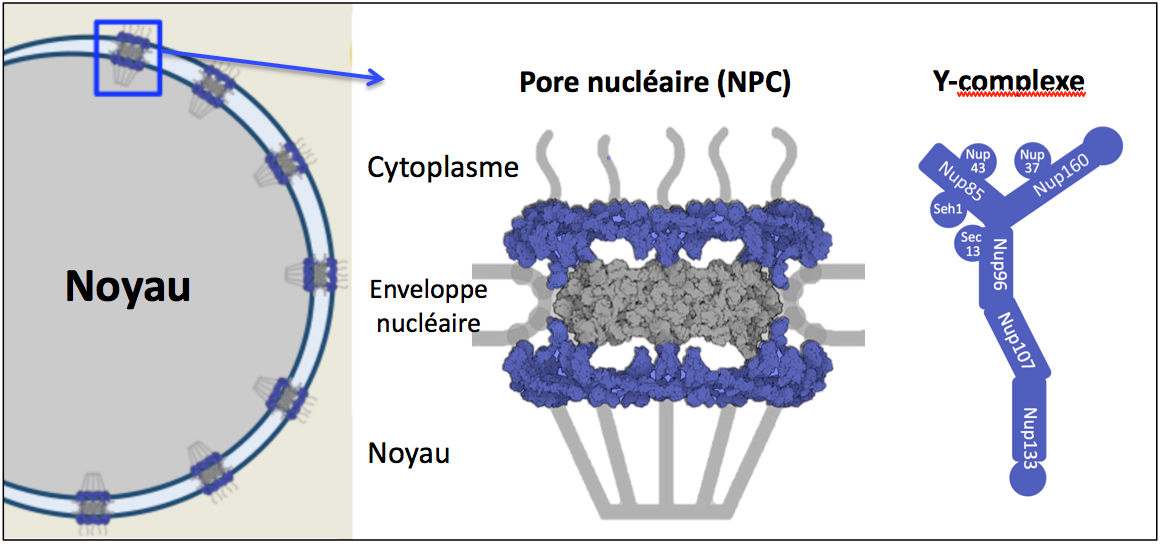 Figure 1: Représentation schématique d’un pore nucléaire et des nucléoporines qui composent le Y-complexe.
Figure 1: Représentation schématique d’un pore nucléaire et des nucléoporines qui composent le Y-complexe.
Nous poursuivons actuellement l’étude des fonctions, de la régulation et des partenaires directs de ces nucléoporines dans ces activités » non conventionnelles « . Pour ce faire, nous utilisons des approches d’imagerie, de biochimie et de génétique (stratégies CRISPR/Cas9), principalement dans des cellules souches pluripotentes murines et humaines (mESCs et hiPSCs) et leurs dérivés différenciés en 2D et 3D.
Projet 1 : Implication des nucléoporines du Y-complexe dans la différenciation des cellules souches embryonnaires murines (mESCs)
Notre équipe a précédemment montré que plusieurs Nups du Y-complexe, à savoir Nup133, Seh1 et Nup43, ne sont pas requises pour la viabilité des cellules souches embryonnaires de souris (mESCs) à l’état pluripotent mais sont nécessaires à leur survie lors des étapes précoces de leur différenciation (Lupu et al., 2008 ; Gonzalez-Estevez, Verrico et al., 2021). Par ailleurs, nous avons démontré que dans les mESCs, Nup133 est nécessaire pour l’assemblage correct du panier du pore nucléaire (Souquet et al., 2018) alors que les mutations touchant les composants du bras court du Y-complexe (Nup85, Seh1 et Nup43) affectent la densité des NPCs (Gonzalez-Estevez, Verrico et al., 2021).
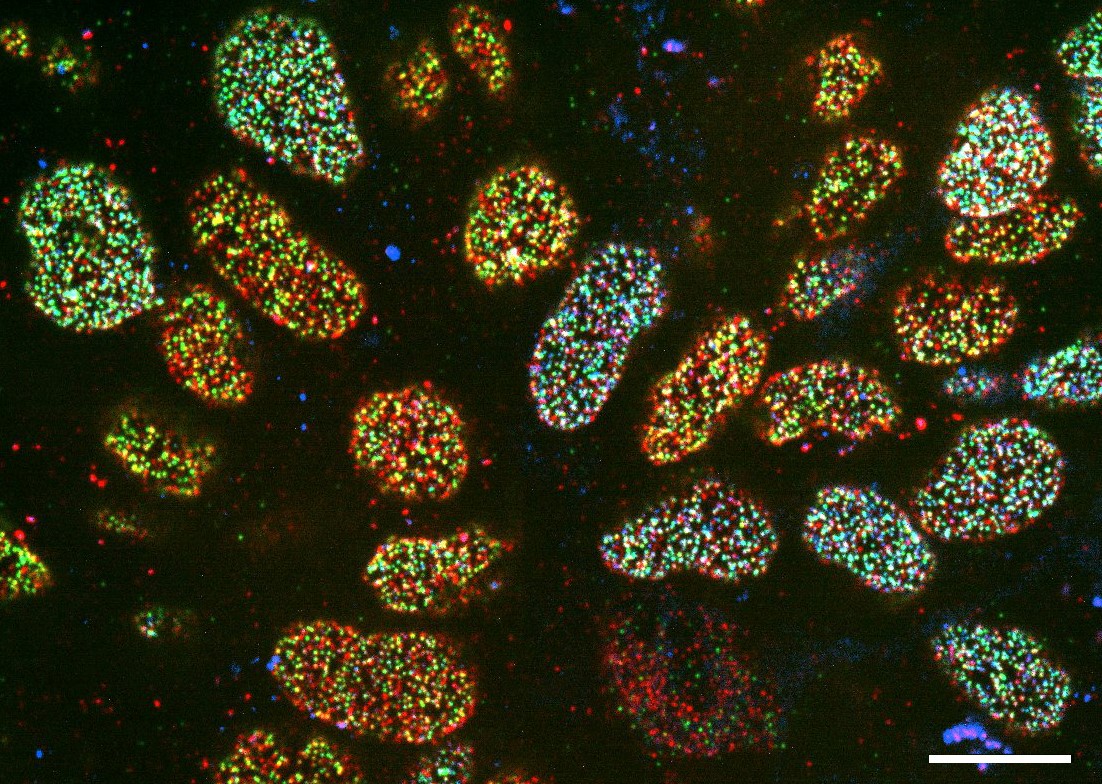
Figure 2 : Etude des pores nucléaires dans les progéniteurs neuraux dérivés de mESCs exprimant différents niveaux de GFP-Nup133 (en bleu), et marquées avec des anticorps dirigés contre Nup153 (en rouge) et TPR (en vert). Barre d’échelle, 10 µm.
Enfin, une approche par RNA-seq a permis d’identifier des gènes cibles régulés par Nup133 au cours d’étapes précoces de la différenciation neuronale (résultats non publiés de notre équipe, en collaboration avec le laboratoire de génomique de l’IBENS, Paris, France). Nous validons actuellement ces gènes cibles et caractérisons les mécanismes par lesquels le Y-complexe contribue à leur régulation.
Projet 2 : Mécanismes moléculaires et cellulaires conduisant à la microcéphalie et/ou aux syndromes néphrotiques.
Au cours des dernières années, plusieurs équipes ont identifié des mutations dans les gènes codant pour les nucléoporines du Y-complexe, chez des patients présentant une maladie rénale précoce et sévère (syndrome néphrotique résistant aux stéroïdes, SRNS), et/ou des troubles du développement neurologique, principalement la microcéphalie. Cependant, on ne comprend pas actuellement pourquoi des mutations dans ces Nups exprimées de manière ubiquitaire conduisent à des pathologies affectant principalement le rein et/ou le cerveau.
Pour aborder cette question, nous utilisons soit des cellules souches pluripotentes induites (iPSCs) générées à partir de cellules sanguines de patients présentant des mutations dans les gènes codant pour des Nups (collaboration avec C. Antignac et la plateforme iPSCs de l’Institut Imagine), soit des iPSCs provenant d’individus sains dans lesquelles des mutations sont introduites par édition du génome (avec l’aide de la plateforme enSCORE – labex who am I ?).
Afin d’étudier les fonctions impactées dans des organes ou des types cellulaires pertinents au regard des pathologies étudiées, les iPSCs sont ensuite différenciées en organoïdes cérébraux (avec l’aide de la plateforme enSCORE) (Figure 3) ou rénaux (en collaboration avec l’équipe de C. Antignac et G. Mollet, Institut Imagine ).
Nous étudions ensuite, dans les cellules pluripotentes et dans les organoïdes qui en sont dérivés, l’impact de ces mutations sur l’assemblage des NPCs, le transport nucléaire, la division et la migration cellulaire, et la régulation des gènes. Nous cherchons également à caractériser les partenaires de ces nucléoporines qui pourraient expliquer les altérations tissus-spécifiques observées chez les patients.
Ces travaux devraient contribuer à la compréhension des mécanismes par lesquels des mutations ou une mauvaise régulation de ces nucléoporines conduisent à diverses pathologies.
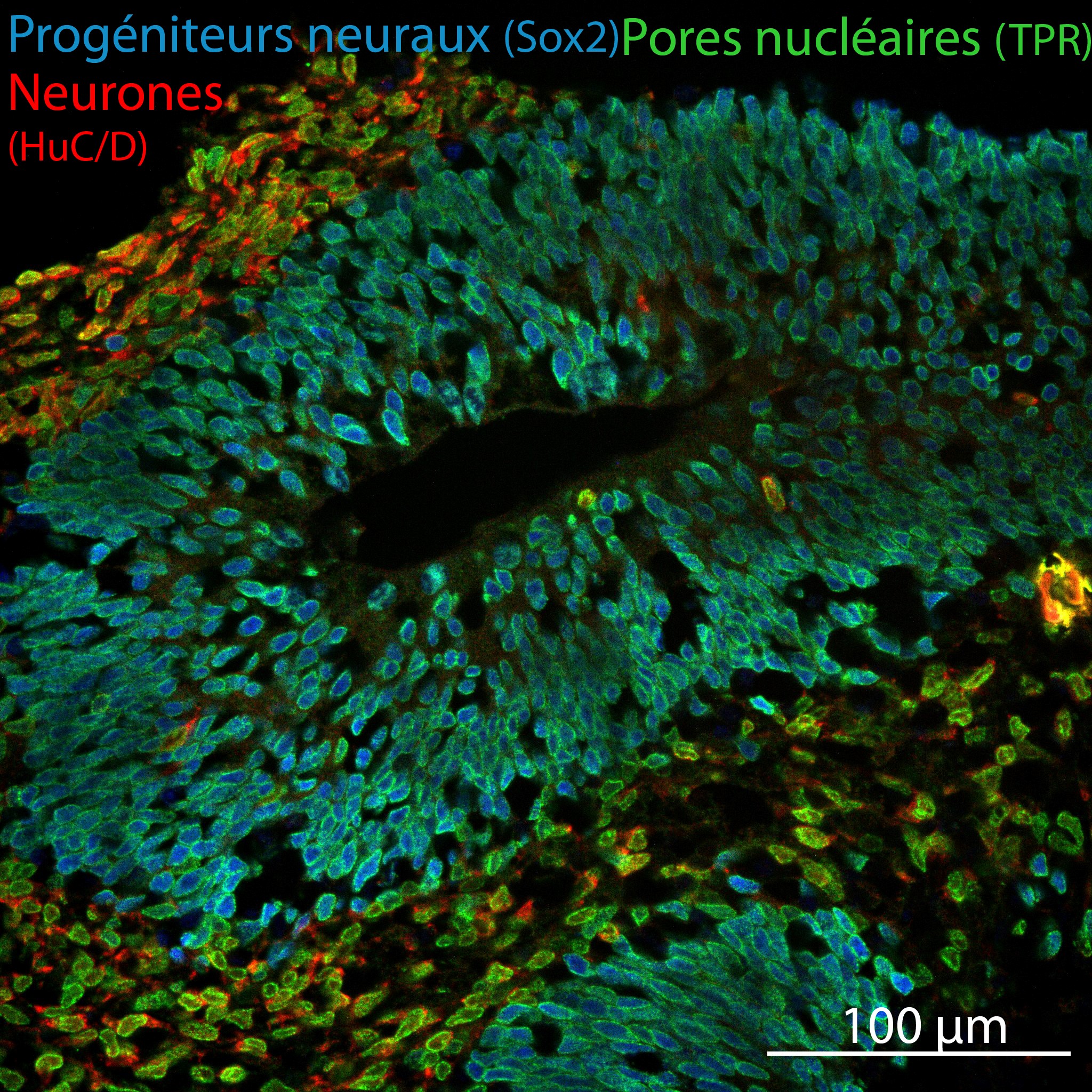 Figure 3: Cryosection d’un organoïde cérébral au jour 38 de différenciation
Figure 3: Cryosection d’un organoïde cérébral au jour 38 de différenciation
Modèles : cellules souches pluripotentes (mESCs et hiPSCs), organoïdes, lignées cellulaires primaires et cancéreuses
Méthodes : édition du génome, différenciation cellulaire, imagerie cellulaire, transcriptomique, biochimie.
Membres
Membres
Brigitte BUENDIA,
Researcher,
DOYE LAB+33 (0)1 57 27 80 60, bureau 344B
Roger KARESS,
Emeritus researcher,
DOYE LAB+33 (0)1 57 27 80 95, bureau 344B
Stephanie MORCHOISNE,
Biology engineer,
DOYE LAB+33 (0)1 57 27 80 61, bureau 342B
Ona PRAT PLANAS,
PhD student,
DOYE LAB+33 (0)1 57 27 80 62, bureau 342B
Nathalie VADROT,
Biology engineer,
DOYE LAB+33 (0)1 57 27 80 61, bureau 342B
Cassandra VORMS,
Intern,
DOYE LAB+33 (0)1 57 27 80 62, bureau 342B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
Sélection de publications
Nuclear pores safeguard the integrity of the nuclear envelope. Taniguchi, R., Orniacki, C., Kreysing, J. P., Zila, V., Zimmerli, C. E., Böhm, S., Turoňová, B., Kräusslich, H.-G., Doye, V., & Beck, M. (2025). Nature Cell Biology, 1–14. https://doi.org/10.1038/s41556-025-01648-3
Opening the gate: Complexity and modularity of the nuclear pore scaffold and basket. Dultz, E., & Doye, V. (2025). Current Opinion in Cell Biology, 92, 102461. https://doi.org/10.1016/j.ceb.2024.102461
Y-complex nucleoporins independently contribute to nuclear pore assembly and gene regulation in neuronal progenitors. Orniacki C., Verrico A., Pelletier S., Souquet B., Coulpier F., Jourdren L., Benetti S., & Doye V. J Cell Sci. 2023 Jun 1;136(11):jcs261151. doi: 10.1242/jcs.261151. PMID: 37305998 https://doi.org/10.1242/jcs.261151
Integrity of the short arm of the nuclear pore Y-complex is required for mouse embryonic stem cell growth and differentiation. Gonzalez-Estevez A, Verrico A, Orniacki C, Reina-San-Martin B, Doye V. J Cell Sci. 2021 May 15;134(10):jcs258340. doi: 10.1242/jcs.258340. PMID: 34037234
Moderate Nucleoporin 133 deficiency leads to glomerular damage in zebrafish. Cianciolo Cosentino C, Berto A, Pelletier S, Hari M, Loffing J, Neuhauss SCF, Doye V. Sci Rep. 2019 Mar 18;9(1):4750. doi: 10.1038/s41598-019-41202-4. PMID: 30894603
Nup133 Is Required for Proper Nuclear Pore Basket Assembly and Dynamics in Embryonic Stem Cells. Souquet B, Freed E, Berto A, Andric V, Audugé N, Reina-San-Martin B, Lacy E, Doye V. Cell Rep. 2018 May 22;23(8):2443-2454. doi: 10.1016/j.celrep.2018.04.070. PMID: 29791854
Disentangling the molecular determinants for Cenp-F localization to nuclear pores and kinetochores. Berto A, Yu J, Morchoisne-Bolhy S, Bertipaglia C, Vallee R, Dumont J, Ochsenbein F, Guerois R, Doye V. EMBO Rep. 2018 May;19(5):e44742. doi: 10.15252/embr.201744742. PMID: 29632243
Probing nuclear pore complex architecture with proximity-dependent biotinylation. Kim DI, Birendra KC, Zhu W, Motamedchaboki K, Doye V, Roux KJ. Proc Natl Acad Sci U S A. 2014 Jun 17;111(24):E2453-61. doi: 10.1073/pnas.1406459111. PMID: 24927568
Dynein recruitment to nuclear pores activates apical nuclear migration and mitotic entry in brain progenitor cells. Hu DJ, Baffet AD, Nayak T, Akhmanova A, Doye V, Vallee RB. Cell. 2013 Sep 12;154(6):1300-13. doi: 10.1016/j.cell.2013.08.024. PMID: 24034252
A Nup133-dependent NPC-anchored network tethers centrosomes to the nuclear envelope in prophase. Bolhy S, Bouhlel I, Dultz E, Nayak T, Zuccolo M, Gatti X, Vallee R, Ellenberg J, Doye V. J Cell Biol. 2011 Mar 7;192(5):855-71. doi: 10.1083/jcb.201007118. PMID: 21383080
Nuclear pore composition regulates neural stem/progenitor cell differentiation in the mouse embryo. Lupu F, Alves A, Anderson K, Doye V, Lacy E. Dev Cell. 2008 Jun;14(6):831-42. doi: 10.1016/j.devcel.2008.03.011. PMID: 18539113
The human Nup107-160 nuclear pore subcomplex contributes to proper kinetochore functions. Zuccolo M, Alves A, Galy V, Bolhy S, Formstecher E, Racine V, Sibarita JB, Fukagawa T, Shiekhattar R, Yen T, Doye V. EMBO J. 2007 Apr 4;26(7):1853-64. doi: 10.1038/sj.emboj.7601642. PMID: 17363900
The conserved Nup107-160 complex is critical for nuclear pore complex assembly. Walther TC, Alves A, Pickersgill H, Loïodice I, Hetzer M, Galy V, Hülsmann BB, Köcher T, Wilm M, Allen T, Mattaj IW, Doye V. Cell. 2003 Apr 18;113(2):195-206. doi: 10.1016/s0092-8674(03)00235-6. PMID: 12705868
Toutes les publications depuis 2017
Publications
2913254
YZUD6P7F
1
apa
50
date
desc
8019
https://www.ijm.fr/wp-content/plugins/zotpress/
%7B%22status%22%3A%22success%22%2C%22updateneeded%22%3Afalse%2C%22instance%22%3Afalse%2C%22meta%22%3A%7B%22request_last%22%3A0%2C%22request_next%22%3A0%2C%22used_cache%22%3Atrue%7D%2C%22data%22%3A%5B%7B%22key%22%3A%22D2N4HSDA%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Taniguchi%20et%20al.%22%2C%22parsedDate%22%3A%222025-04-09%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BTaniguchi%2C%20R.%2C%20Orniacki%2C%20C.%2C%20Kreysing%2C%20J.%20P.%2C%20Zila%2C%20V.%2C%20Zimmerli%2C%20C.%20E.%2C%20B%26%23xF6%3Bhm%2C%20S.%2C%20Turo%26%23×148%3Bov%26%23xE1%3B%2C%20B.%2C%20Kr%26%23xE4%3Busslich%2C%20H.-G.%2C%20Doye%2C%20V.%2C%20%26amp%3B%20Beck%2C%20M.%20%282025%29.%20Nuclear%20pores%20safeguard%20the%20integrity%20of%20the%20nuclear%20envelope.%20%26lt%3Bi%26gt%3BNature%20Cell%20Biology%26lt%3B%5C%2Fi%26gt%3B%2C%201%26%23×2013%3B14.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41556-025-01648-3%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41556-025-01648-3%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Nuclear%20pores%20safeguard%20the%20integrity%20of%20the%20nuclear%20envelope%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Reiya%22%2C%22lastName%22%3A%22Taniguchi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Clarisse%22%2C%22lastName%22%3A%22Orniacki%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jan%20Philipp%22%2C%22lastName%22%3A%22Kreysing%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vojtech%22%2C%22lastName%22%3A%22Zila%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Christian%20E.%22%2C%22lastName%22%3A%22Zimmerli%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Stefanie%22%2C%22lastName%22%3A%22B%5Cu00f6hm%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Beata%22%2C%22lastName%22%3A%22Turo%5Cu0148ov%5Cu00e1%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Hans-Georg%22%2C%22lastName%22%3A%22Kr%5Cu00e4usslich%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Martin%22%2C%22lastName%22%3A%22Beck%22%7D%5D%2C%22abstractNote%22%3A%22Nuclear%20pore%20complexes%20%28NPCs%29%20mediate%20nucleocytoplasmic%20exchange%2C%20which%20is%20essential%20for%20eukaryotes.%20Mutations%20in%20the%20central%20scaffolding%20components%20of%20NPCs%20are%20associated%20with%20genetic%20diseases%2C%20but%20how%20they%20manifest%20only%20in%20specific%20tissues%20remains%20unclear.%20This%20is%20exemplified%20in%20Nup133-deficient%20mouse%20embryonic%20stem%20cells%2C%20which%20grow%20normally%20during%20pluripotency%2C%20but%20differentiate%20poorly%20into%20neurons.%20Here%2C%20using%20an%20innovative%20in%20situ%20structural%20biology%20approach%2C%20we%20show%20that%20Nup133%5Cu2212%5C%2F%5Cu2212%20mouse%20embryonic%20stem%20cells%20have%20heterogeneous%20NPCs%20with%20non-canonical%20symmetries%20and%20missing%20subunits.%20During%20neuronal%20differentiation%2C%20Nup133-deficient%20NPCs%20frequently%20disintegrate%2C%20resulting%20in%20abnormally%20large%20nuclear%20envelope%20openings.%20We%20propose%20that%20the%20elasticity%20of%20the%20NPC%20scaffold%20has%20a%20protective%20function%20for%20the%20nuclear%20envelope%20and%20that%20its%20perturbation%20becomes%20critical%20under%20conditions%20that%20impose%20an%20increased%20mechanical%20load%20onto%20nuclei.%22%2C%22date%22%3A%222025-04-09%22%2C%22language%22%3A%22en%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41556-025-01648-3%22%2C%22ISSN%22%3A%221476-4679%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fwww.nature.com%5C%2Farticles%5C%2Fs41556-025-01648-3%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222025-04-11T12%3A29%3A26Z%22%7D%7D%2C%7B%22key%22%3A%22FGBLJQ3Y%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Dultz%20and%20Doye%22%2C%22parsedDate%22%3A%222025-02-01%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BDultz%2C%20E.%2C%20%26amp%3B%20Doye%2C%20V.%20%282025%29.%20Opening%20the%20gate%3A%20Complexity%20and%20modularity%20of%20the%20nuclear%20pore%20scaffold%20and%20basket.%20%26lt%3Bi%26gt%3BCurrent%20Opinion%20in%20Cell%20Biology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B92%26lt%3B%5C%2Fi%26gt%3B%2C%20102461.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.ceb.2024.102461%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.ceb.2024.102461%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Opening%20the%20gate%3A%20Complexity%20and%20modularity%20of%20the%20nuclear%20pore%20scaffold%20and%20basket%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Elisa%22%2C%22lastName%22%3A%22Dultz%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22Nuclear%20pore%20complexes%20%28NPCs%29%20are%20giant%20molecular%20assemblies%20that%20form%20the%20gateway%20between%20the%20nucleus%20and%20the%20cytoplasm%20and%20accommodate%20the%20bidirectional%20transport%20of%20a%20large%20variety%20of%20cargoes.%20Recent%20years%20have%20seen%20tremendous%20advances%20in%20our%20understanding%20of%20their%20building%20principles%20and%20have%20in%20particular%20called%20attention%20to%20the%20flexibility%20and%20variability%20of%20NPC%20composition%20and%20structure.%20Here%2C%20we%20review%20these%20recent%20advances%20and%20discuss%20how%20the%20newest%20technologies%20push%20the%20boundaries%20of%20nuclear%20pore%20research%20forward%2C%20with%20a%20specific%20highlight%20on%20the%20NPC%20scaffold%20and%20a%20prominent%20pore%20appendage%2C%20the%20nuclear%20basket%2C%20whose%20architecture%20has%20long%20been%20elusive.%22%2C%22date%22%3A%222025-02-01%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.ceb.2024.102461%22%2C%22ISSN%22%3A%220955-0674%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fwww.sciencedirect.com%5C%2Fscience%5C%2Farticle%5C%2Fpii%5C%2FS0955067424001406%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222025-01-23T08%3A57%3A43Z%22%7D%7D%2C%7B%22key%22%3A%22G4GB3Z2I%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Nobari%20et%20al.%22%2C%22parsedDate%22%3A%222023-10-01%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BNobari%2C%20P.%2C%20Doye%2C%20V.%2C%20%26amp%3B%20Boumendil%2C%20C.%20%282023%29.%20Metazoan%20nuclear%20pore%20complexes%20in%20gene%20regulation%20and%20genome%20stability.%20%26lt%3Bi%26gt%3BDNA%20Repair%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B130%26lt%3B%5C%2Fi%26gt%3B%2C%20103565.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.dnarep.2023.103565%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.dnarep.2023.103565%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Metazoan%20nuclear%20pore%20complexes%20in%20gene%20regulation%20and%20genome%20stability%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Parisa%22%2C%22lastName%22%3A%22Nobari%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Charlene%22%2C%22lastName%22%3A%22Boumendil%22%7D%5D%2C%22abstractNote%22%3A%22The%20nuclear%20pore%20complexes%20%28NPCs%29%2C%20one%20of%20the%20hallmarks%20of%20eukaryotic%20nuclei%2C%20allow%20selective%20transport%20of%20macromolecules%20between%20the%20cytoplasm%20and%20the%20nucleus.%20Besides%20this%20canonical%20function%2C%20an%20increasing%20number%20of%20additional%20roles%20have%20been%20attributed%20to%20the%20NPCs%20and%20their%20constituents%2C%20the%20nucleoporins.%20Here%20we%20review%20recent%20insights%20into%20the%20mechanisms%20by%20which%20NPCs%20and%20nucleoporins%20affect%20transcription%20and%20DNA%20repair%20in%20metazoans.%20In%20the%20first%20part%2C%20we%20discuss%20how%20gene%20expression%20can%20be%20affected%20by%20the%20localization%20of%20genome-nucleoporin%20interactions%20at%20pores%20or%20%5Cu201coff-pores%5Cu201d%2C%20by%20the%20role%20of%20nucleoporins%20in%20chromatin%20organization%20at%20different%20scales%2C%20or%20by%20the%20physical%20properties%20of%20nucleoporins.%20In%20the%20second%20part%2C%20we%20review%20the%20contribution%20of%20NPCs%20to%20genome%20stability%2C%20including%20transport-dependent%20and%20-independent%20functions%20and%20the%20role%20of%20positioning%20at%20NPCs%20in%20the%20repair%20of%20heterochromatic%20breaks%20and%20the%20regulation%20of%20replication%20stress.%22%2C%22date%22%3A%222023-10-01%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.dnarep.2023.103565%22%2C%22ISSN%22%3A%221568-7864%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fwww.sciencedirect.com%5C%2Fscience%5C%2Farticle%5C%2Fpii%5C%2FS1568786423001192%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222023-09-12T08%3A20%3A11Z%22%7D%7D%2C%7B%22key%22%3A%22K25BXYEV%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Orniacki%20et%20al.%22%2C%22parsedDate%22%3A%222023-05-17%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BOrniacki%2C%20C.%2C%20Verrico%2C%20A.%2C%20Pelletier%2C%20S.%2C%20Souquet%2C%20B.%2C%20Coulpier%2C%20F.%2C%20Jourdren%2C%20L.%2C%20Benetti%2C%20S.%2C%20%26amp%3B%20Doye%2C%20V.%20%282023%29.%20Y-complex%20nucleoporins%20independently%20contribute%20to%20nuclear%20pore%20assembly%20and%20gene%20regulation%20in%20neuronal%20progenitors.%20%26lt%3Bi%26gt%3BJournal%20of%20Cell%20Science%26lt%3B%5C%2Fi%26gt%3B%2C%20jcs.261151.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fjcs.261151%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fjcs.261151%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Y-complex%20nucleoporins%20independently%20contribute%20to%20nuclear%20pore%20assembly%20and%20gene%20regulation%20in%20neuronal%20progenitors%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Clarisse%22%2C%22lastName%22%3A%22Orniacki%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Annalisa%22%2C%22lastName%22%3A%22Verrico%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Pelletier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Benoit%22%2C%22lastName%22%3A%22Souquet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fanny%22%2C%22lastName%22%3A%22Coulpier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Laurent%22%2C%22lastName%22%3A%22Jourdren%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Serena%22%2C%22lastName%22%3A%22Benetti%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22Besides%20assembling%20nuclear%20pore%20complexes%2C%20the%20conduits%20of%20nuclear%20transport%2C%20many%20nucleoporins%20also%20contribute%20to%20chromatin%20organization%20and%20gene%20expression%2C%20with%20critical%20roles%20in%20development%20and%20pathologies.%20We%20previously%20reported%20that%20Nup133%20and%20Seh1%2C%20two%20components%20of%20the%20Y-complex%20subassembly%20of%20the%20nuclear%20pore%20scaffold%2C%20are%20dispensable%20for%20mouse%20embryonic%20stem%20cell%20viability%20but%20required%20for%20their%20survival%20during%20neuroectodermal%20differentiation.%20Here%2C%20a%20transcriptomic%20analysis%20revealed%20that%20Nup133%20regulates%20a%20subset%20of%20genes%20at%20early%20stages%20of%20neuroectodermal%20differentiation%2C%20including%20Lhx1%20and%20Nup210L%2C%20encoding%20a%20newly%20validated%20nucleoporin.%20These%20genes%20are%20also%20misregulated%20in%20Nup133%5Cu25b5Mid%20neuronal%20progenitors%2C%20in%20which%20nuclear%20pore%20basket%20assembly%20is%20impaired.%20However%2C%20a%20four-fold%20reduction%20of%20Nup133%2C%20despite%20also%20affecting%20basket%20assembly%2C%20is%20not%20sufficient%20to%20alter%20Nup210L%20and%20Lhx1%20expression.%20Finally%2C%20these%20two%20genes%20are%20also%20misregulated%20in%20Seh1-deficient%20neural%20progenitors%20only%20showing%20a%20mild%20reduction%20in%20nuclear%20pore%20density.%20Together%20these%20data%20reveal%20a%20shared%20function%20of%20Y-complex%20nucleoporins%20in%20gene%20regulation%20during%20neuroectodermal%20differentiation%2C%20apparently%20independent%20of%20nuclear%20pore%20basket%20integrity.%22%2C%22date%22%3A%222023-05-17%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1242%5C%2Fjcs.261151%22%2C%22ISSN%22%3A%221477-9137%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222023-05-23T10%3A21%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22QR7AUZT7%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Bouglita%20et%20al.%22%2C%22parsedDate%22%3A%222022-09-26%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BBouglita%2C%20W.%2C%20Rabhi%2C%20S.%2C%20Raich%2C%20N.%2C%20Bouabid%2C%20C.%2C%20Belghith%2C%20C.%2C%20Slimani%2C%20O.%2C%20Hkimi%2C%20C.%2C%20Ghedira%2C%20K.%2C%20Karess%2C%20R.%20E.%2C%20Guizani-Tabbane%2C%20L.%2C%20Attia%2C%20L.%2C%20%26amp%3B%20Rabhi%2C%20I.%20%282022%29.%20Microbiological%20and%20molecular%20screening%20of%20Candida%20spp.%20isolated%20from%20genital%20tract%20of%20asymptomatic%20pregnant%20women.%20%26lt%3Bi%26gt%3BJournal%20of%20Medical%20Microbiology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B71%26lt%3B%5C%2Fi%26gt%3B%289%29%2C%20001589.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1099%5C%2Fjmm.0.001589%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1099%5C%2Fjmm.0.001589%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Microbiological%20and%20molecular%20screening%20of%20Candida%20spp.%20isolated%20from%20genital%20tract%20of%20asymptomatic%20pregnant%20women%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Wafa%22%2C%22lastName%22%3A%22Bouglita%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Sameh%22%2C%22lastName%22%3A%22Rabhi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Natacha%22%2C%22lastName%22%3A%22Raich%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Cyrine%22%2C%22lastName%22%3A%22Bouabid%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Cyrine%22%2C%22lastName%22%3A%22Belghith%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Olfa%22%2C%22lastName%22%3A%22Slimani%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chaima%22%2C%22lastName%22%3A%22Hkimi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Kais%22%2C%22lastName%22%3A%22Ghedira%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Roger%20E.%22%2C%22lastName%22%3A%22Karess%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lamia%22%2C%22lastName%22%3A%22Guizani-Tabbane%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Leila%22%2C%22lastName%22%3A%22Attia%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Imen%22%2C%22lastName%22%3A%22Rabhi%22%7D%5D%2C%22abstractNote%22%3A%22Introduction.%20Candida%20spp.%20may%20cause%20opportunistic%20infections%20called%20vulvovaginal%20candidiasis%20%28VVC%29%2C%20which%20is%20estimated%20to%20be%20the%20second%20most%20common%20cause%20of%20vaginitis%20worldwide.%20Gap%20Statement.%20Under%20various%20circumstances%2C%20VVC%20could%20compromise%20pregnancy%20outcomes.%20Emerging%20data%20suggests%20that%20VVC%20during%20pregnancy%20may%20be%20associated%20with%20increased%20risk%20of%20complications%20and%20congenital%20cutaneous%20candidiasis.%20Aim.%20To%20assess%20the%20prevalence%20of%20Candida%20spp.%20in%20asymptomatic%20pregnant%20women%20and%20determine%20the%20susceptibility%20of%20the%20isolates%20to%20antifungal%20drugs.%20Methodology.%20In%20a%20prospective%20cohort%2C%2065%20high%20vaginal%20swab%20samples%20of%20consented%20pregnant%20women.%20Candida%20isolates%20were%20identified%20using%20both%20microbiological%20and%20molecular%20tools%20and%20drug%20susceptibilities%20were%20profiled.%20Results.%20The%20prevalence%20of%20VVC%20among%20our%20study%20participants%20was%2037%20%25%2C%2024%20of%20the%2065%20asymptomatic%20pregnant%20women%20show%20Candida%20spp.%20colonization.%20C.%20albicans%20was%20the%20most%20common%20species%2061%20%25%2C%20followed%20by%20C.%20glabrata%2039%20%25.%20In%20addition%2C%20a%20significant%20fraction%20of%20the%20isolated%20colonies%20showed%20resistance%20to%20Fluconazole%2C%20with%20a%20ratio%20of%2063%20%25%20for%20C.%20albicans%20isolates%20and%2016%20%25%20for%20Candida%20glabrata%20isolates.%20Moreover%2C%20relative%20quantification%20of%20genes%20related%20to%20resistance%20to%20fluconazole%2C%20CDR1%2C%20ERG11%20as%20well%20as%20HWP1%2C%20showed%20a%20significant%20change%20compared%20to%20controls.%20Conclusion.%20Monitoring%20of%20vaginal%20Candida%20colonization%20before%20the%20third%20trimester%20of%20pregnancy%2C%20that%20could%20reduce%20congenital%20Candida%20colonization%20and%20risk%20of%20pregnancy%20complications.%22%2C%22date%22%3A%222022%5C%2F09%5C%2F26%22%2C%22language%22%3A%22en%22%2C%22DOI%22%3A%2210.1099%5C%2Fjmm.0.001589%22%2C%22ISSN%22%3A%220022-2615%2C%201473-5644%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fwww.microbiologyresearch.org%5C%2Fcontent%5C%2Fjournal%5C%2Fjmm%5C%2F10.1099%5C%2Fjmm.0.001589%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222023-05-23T12%3A07%3A18Z%22%7D%7D%2C%7B%22key%22%3A%22T89XWD3E%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Olley%20et%20al.%22%2C%22parsedDate%22%3A%222021-05-25%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BOlley%2C%20G.%2C%20Pradeepa%2C%20M.%20M.%2C%20Grimes%2C%20G.%20R.%2C%20Piquet%2C%20S.%2C%20Polo%2C%20S.%20E.%2C%20FitzPatrick%2C%20D.%20R.%2C%20Bickmore%2C%20W.%20A.%2C%20%26amp%3B%20Boumendil%2C%20C.%20%282021%29.%20Cornelia%26%23xA0%3Bde%20Lange%20syndrome-associated%20mutations%20cause%20a%20DNA%20damage%20signalling%20and%20repair%20defect.%20%26lt%3Bi%26gt%3BNature%20Communications%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B12%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%203127.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41467-021-23500-6%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41467-021-23500-6%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Cornelia%5Cu00a0de%20Lange%20syndrome-associated%20mutations%20cause%20a%20DNA%20damage%20signalling%20and%20repair%20defect%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gabrielle%22%2C%22lastName%22%3A%22Olley%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Madapura%20M.%22%2C%22lastName%22%3A%22Pradeepa%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Graeme%20R.%22%2C%22lastName%22%3A%22Grimes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Sandra%22%2C%22lastName%22%3A%22Piquet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Sophie%20E.%22%2C%22lastName%22%3A%22Polo%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22David%20R.%22%2C%22lastName%22%3A%22FitzPatrick%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Wendy%20A.%22%2C%22lastName%22%3A%22Bickmore%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Charlene%22%2C%22lastName%22%3A%22Boumendil%22%7D%5D%2C%22abstractNote%22%3A%22Cornelia%20de%20Lange%20syndrome%20is%20a%20multisystem%20developmental%20disorder%20typically%20caused%20by%20mutations%20in%20the%20gene%20encoding%20the%20cohesin%20loader%20NIPBL.%20The%20associated%20phenotype%20is%20generally%20assumed%20to%20be%20the%20consequence%20of%20aberrant%20transcriptional%20regulation.%20Recently%2C%20we%20identified%20a%20missense%20mutation%20in%20BRD4%20associated%20with%20a%20Cornelia%20de%20Lange-like%20syndrome%20that%20reduces%20BRD4%20binding%20to%20acetylated%20histones.%20Here%20we%20show%20that%2C%20although%20this%20mutation%20reduces%20BRD4-occupancy%20at%20enhancers%20it%20does%20not%20affect%20transcription%20of%20the%20pluripotency%20network%20in%20mouse%20embryonic%20stem%20cells.%20Rather%2C%20it%20delays%20the%20cell%20cycle%2C%20increases%20DNA%20damage%20signalling%2C%20and%20perturbs%20regulation%20of%20DNA%20repair%20in%20mutant%20cells.%20This%20uncovers%20a%20role%20for%20BRD4%20in%20DNA%20repair%20pathway%20choice.%20Furthermore%2C%20we%20find%20evidence%20of%20a%20similar%20increase%20in%20DNA%20damage%20signalling%20in%20cells%20derived%20from%20NIPBL-deficient%20individuals%2C%20suggesting%20that%20defective%20DNA%20damage%20signalling%20and%20repair%20is%20also%20a%20feature%20of%20typical%20Cornelia%20de%20Lange%20syndrome.%22%2C%22date%22%3A%222021-05-25%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41467-021-23500-6%22%2C%22ISSN%22%3A%222041-1723%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A26%3A24Z%22%7D%7D%2C%7B%22key%22%3A%22N2CVDXA7%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Gonzalez-Estevez%20et%20al.%22%2C%22parsedDate%22%3A%222021-05-15%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BGonzalez-Estevez%2C%20A.%2C%20Verrico%2C%20A.%2C%20Orniacki%2C%20C.%2C%20Reina-San-Martin%2C%20B.%2C%20%26amp%3B%20Doye%2C%20V.%20%282021%29.%20Integrity%20of%20the%20short%20arm%20of%20the%20nuclear%20pore%20Y-complex%20is%20required%20for%20mouse%20embryonic%20stem%20cell%20growth%20and%20differentiation.%20%26lt%3Bi%26gt%3BJournal%20of%20Cell%20Science%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B134%26lt%3B%5C%2Fi%26gt%3B%2810%29%2C%20jcs258340.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fjcs.258340%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fjcs.258340%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Integrity%20of%20the%20short%20arm%20of%20the%20nuclear%20pore%20Y-complex%20is%20required%20for%20mouse%20embryonic%20stem%20cell%20growth%20and%20differentiation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alba%22%2C%22lastName%22%3A%22Gonzalez-Estevez%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Annalisa%22%2C%22lastName%22%3A%22Verrico%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Clarisse%22%2C%22lastName%22%3A%22Orniacki%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Bernardo%22%2C%22lastName%22%3A%22Reina-San-Martin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22Many%20cellular%20processes%2C%20ranging%20from%20cell%20division%20to%20differentiation%2C%20are%20controlled%20by%20nuclear%20pore%20complexes%20%28NPCs%29.%20However%2C%20studying%20the%20contributions%20of%20individual%20NPC%20subunits%20to%20these%20processes%20in%20vertebrates%20has%20long%20been%20impeded%20by%20their%20complexity%20and%20the%20lack%20of%20efficient%20genetic%20tools.%20Here%2C%20we%20use%20genome%20editing%20in%20mouse%20embryonic%20stem%20cells%20%28mESCs%29%20to%20characterize%20the%20role%20of%20NPC%20structural%20components%2C%20focusing%20on%20the%20short%20arm%20of%20the%20Y-complex%20that%20comprises%20Nup85%2C%20Seh1%20and%20Nup43.%20We%20show%20that%20Seh1%20and%20Nup43%2C%20although%20dispensable%20in%20pluripotent%20mESCs%2C%20are%20required%20for%20their%20normal%20cell%20growth%20rates%2C%20their%20viability%20upon%20differentiation%20and%20for%20the%20maintenance%20of%20proper%20NPC%20density.%20mESCs%20with%20an%20N-terminally%20truncated%20Nup85%20mutation%20%28in%20which%20interaction%20with%20Seh1%20is%20greatly%20impaired%29%20feature%20a%20similar%20reduction%20of%20NPC%20density.%20However%2C%20their%20proliferation%20and%20differentiation%20are%20unaltered%2C%20indicating%20that%20it%20is%20the%20integrity%20of%20the%20Y-complex%2C%20rather%20than%20the%20number%20of%20NPCs%2C%20that%20is%20critical%20to%20ensure%20these%20processes.%22%2C%22date%22%3A%222021-05-15%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1242%5C%2Fjcs.258340%22%2C%22ISSN%22%3A%221477-9137%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A26%3A24Z%22%7D%7D%2C%7B%22key%22%3A%228XJCA2PX%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Raich%20et%20al.%22%2C%22parsedDate%22%3A%222020-08-27%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BRaich%2C%20N.%2C%20Contremoulins%2C%20V.%2C%20%26amp%3B%20Karess%2C%20R.%20E.%20%282020%29.%20Immunostaining%20of%20Whole-Mount%20Drosophila%20Testes%20for%203D%20Confocal%20Analysis%20of%20Large%20Spermatocytes.%20%26lt%3Bi%26gt%3BJournal%20of%20Visualized%20Experiments%3A%20JoVE%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B162%26lt%3B%5C%2Fi%26gt%3B.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.3791%5C%2F61061%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.3791%5C%2F61061%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Immunostaining%20of%20Whole-Mount%20Drosophila%20Testes%20for%203D%20Confocal%20Analysis%20of%20Large%20Spermatocytes%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Natacha%22%2C%22lastName%22%3A%22Raich%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vincent%22%2C%22lastName%22%3A%22Contremoulins%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Roger%20E.%22%2C%22lastName%22%3A%22Karess%22%7D%5D%2C%22abstractNote%22%3A%22Drosophila%20testes%20are%20a%20powerful%20model%20system%20for%20studying%20biological%20processes%20including%20stem%20cell%20biology%2C%20nuclear%20architecture%2C%20meiosis%20and%20sperm%20development.%20However%2C%20immunolabeling%20of%20the%20whole%20Drosophila%20testis%20is%20often%20associated%20with%20significant%20non-uniformity%20of%20staining%20due%20to%20antibody%20penetration.%20Squashed%20preparations%20only%20partially%20overcome%20the%20problem%20since%20it%20decreases%20the%203D%20quality%20of%20the%20analyses.%20Herein%2C%20we%20describe%20a%20whole-mount%20protocol%20using%20NP40%20and%20heptane%20during%20fixation%20together%20with%20immunolabeling%20in%20liquid%20media.%20It%20preserves%20the%20volume%20suitable%20for%20confocal%20microscopy%20together%20with%20reproducible%20and%20reliable%20labeling.%20We%20show%20different%20examples%20of%203D%20reconstitution%20of%20spermatocyte%20nuclei%20from%20confocal%20sections.%20The%20intra-%20and%20inter-testes%20reproducibility%20allows%203D%20quantification%20and%20comparison%20of%20fluorescence%20between%20single%20cells%20from%20different%20genotypes.%20We%20used%20different%20components%20of%20the%20intranuclear%20MINT%20structure%20%28Mad1-containing%20Intra%20Nuclear%20Territory%29%20as%20well%20as%20two%20components%20associated%20with%20the%20nuclear%20pore%20complex%20to%20illustrate%20this%20protocol%20and%20its%20applications%20on%20the%20largest%20cells%20of%20the%20testis%2C%20the%20S4-S5%20spermatocytes.%22%2C%22date%22%3A%222020-08-27%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.3791%5C%2F61061%22%2C%22ISSN%22%3A%221940-087X%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222023-07-31T14%3A57%3A02Z%22%7D%7D%2C%7B%22key%22%3A%22K737AHE4%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Cianciolo%20Cosentino%20et%20al.%22%2C%22parsedDate%22%3A%222020-02-19%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BCianciolo%20Cosentino%2C%20C.%2C%20Berto%2C%20A.%2C%20Pelletier%2C%20S.%2C%20Hari%2C%20M.%2C%20Loffing%2C%20J.%2C%20Neuhauss%2C%20S.%20C.%20F.%2C%20%26amp%3B%20Doye%2C%20V.%20%282020%29.%20Publisher%20Correction%3A%20Moderate%20Nucleoporin%20133%20deficiency%20leads%20to%20glomerular%20damage%20in%20zebrafish.%20%26lt%3Bi%26gt%3BScientific%20Reports%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B10%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%203326.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41598-020-58959-8%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41598-020-58959-8%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Publisher%20Correction%3A%20Moderate%20Nucleoporin%20133%20deficiency%20leads%20to%20glomerular%20damage%20in%20zebrafish%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chiara%22%2C%22lastName%22%3A%22Cianciolo%20Cosentino%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandro%22%2C%22lastName%22%3A%22Berto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Pelletier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Michelle%22%2C%22lastName%22%3A%22Hari%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Johannes%22%2C%22lastName%22%3A%22Loffing%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Stephan%20C.%20F.%22%2C%22lastName%22%3A%22Neuhauss%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22An%20amendment%20to%20this%20paper%20has%20been%20published%20and%20can%20be%20accessed%20via%20a%20link%20at%20the%20top%20of%20the%20paper.%22%2C%22date%22%3A%222020-02-19%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41598-020-58959-8%22%2C%22ISSN%22%3A%222045-2322%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A26%3A54Z%22%7D%7D%2C%7B%22key%22%3A%225GCFTI93%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Cianciolo%20Cosentino%20et%20al.%22%2C%22parsedDate%22%3A%222020-01-15%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BCianciolo%20Cosentino%2C%20C.%2C%20Berto%2C%20A.%2C%20Pelletier%2C%20S.%2C%20Hari%2C%20M.%2C%20Loffing%2C%20J.%2C%20Neuhauss%2C%20S.%20C.%20F.%2C%20%26amp%3B%20Doye%2C%20V.%20%282020%29.%20Author%20Correction%3A%20Moderate%20Nucleoporin%20133%20deficiency%20leads%20to%20glomerular%20damage%20in%20zebrafish.%20%26lt%3Bi%26gt%3BScientific%20Reports%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B10%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%20756.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41598-020-57829-7%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41598-020-57829-7%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Author%20Correction%3A%20Moderate%20Nucleoporin%20133%20deficiency%20leads%20to%20glomerular%20damage%20in%20zebrafish%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chiara%22%2C%22lastName%22%3A%22Cianciolo%20Cosentino%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandro%22%2C%22lastName%22%3A%22Berto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Pelletier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Michelle%22%2C%22lastName%22%3A%22Hari%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Johannes%22%2C%22lastName%22%3A%22Loffing%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Stephan%20C.%20F.%22%2C%22lastName%22%3A%22Neuhauss%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22An%20amendment%20to%20this%20paper%20has%20been%20published%20and%20can%20be%20accessed%20via%20a%20link%20at%20the%20top%20of%20the%20paper.%22%2C%22date%22%3A%222020-01-15%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41598-020-57829-7%22%2C%22ISSN%22%3A%222045-2322%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A27%3A07Z%22%7D%7D%2C%7B%22key%22%3A%2245SDNZ8J%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Menant%20and%20Karess%22%2C%22parsedDate%22%3A%222020%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BMenant%2C%20A.%2C%20%26amp%3B%20Karess%2C%20R.%20E.%20%282020%29.%20Mutations%20in%20the%20Drosophila%20rough%20deal%20gene%20affecting%20RZZ%20kinetochore%20function.%20%26lt%3Bi%26gt%3BBiology%20of%20the%20Cell%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B112%26lt%3B%5C%2Fi%26gt%3B%2810%29%2C%20300%26%23×2013%3B315.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1111%5C%2Fboc.201900105%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1111%5C%2Fboc.201900105%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Mutations%20in%20the%20Drosophila%20rough%20deal%20gene%20affecting%20RZZ%20kinetochore%20function%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alexandra%22%2C%22lastName%22%3A%22Menant%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Roger%20E.%22%2C%22lastName%22%3A%22Karess%22%7D%5D%2C%22abstractNote%22%3A%22Background%20The%20RZZ%20complex%2C%20composed%20of%20the%20proteins%20Rough-Deal%20%28Rod%29%2C%20Zw10%20and%20Zwilch%2C%20plays%20a%20central%20role%20in%20the%20spindle%20assembly%20checkpoint%20%28SAC%29%2C%20which%20assures%20proper%20sister%20chromatid%20segregation%20during%20mitosis.%20RZZ%20contributes%20to%20the%20regulation%20of%20the%20spindle%20assembly%20checkpoint%20by%20helping%20to%20recruit%20Mad1%5Cu2013Mad2%20and%20the%20microtubule%20motor%20dynein%20to%20unattached%20kinetochores.%20It%20is%20an%20important%20component%20of%20the%20outer%20kinetochore%20and%20specifically%20the%20fibrous%20corona%20whose%20expansion%20is%20believed%20to%20facilitate%20microtubule%20capture.%20How%20RZZ%20carries%20out%20its%20diverse%20activities%20is%20only%20poorly%20understood.%20The%20C-terminal%20region%20of%20the%20Rod%20subunit%20is%20relatively%20well-conserved%20across%20metazoan%20phylogeny%2C%20but%20no%20function%20has%20been%20attributed%20to%20it.%20Results%20To%20explore%20the%20importance%20of%20the%20Rod_C%20domain%20in%20RZZ%20function%20in%20Drosophila%2C%20we%20generated%20a%20series%20of%20point%20mutations%20in%20a%20stretch%20of%20200%20residues%20within%20this%20domain%20and%20we%20report%20here%20their%20phenotypes.%20Several%20of%20the%20mutations%20profoundly%20disrupt%20recruitment%20of%20RZZ%20to%20kinetochores%2C%20including%20one%20in%20a%20temperature-sensitive%20manner%2C%20while%20still%20retaining%20the%20capacity%20to%20assemble%20into%20a%20complex%20with%20Zw10%20and%20Zwilch.%20Others%20affect%20aspects%20of%20dynein%20activity%20or%20recruitment%20at%20the%20kinetochore.%20Conclusions%20and%20Significance%20These%20results%20suggest%20that%20the%20Rod_C%20domain%20participates%20in%20the%20protein%20interactions%20necessary%20for%20RZZ%20recruitment%20and%20functionality%20at%20kinetochores.%22%2C%22date%22%3A%222020%22%2C%22language%22%3A%22en%22%2C%22DOI%22%3A%2210.1111%5C%2Fboc.201900105%22%2C%22ISSN%22%3A%221768-322X%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fonlinelibrary.wiley.com%5C%2Fdoi%5C%2Fabs%5C%2F10.1111%5C%2Fboc.201900105%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222023-05-23T12%3A10%3A59Z%22%7D%7D%2C%7B%22key%22%3A%22GN6B5RFE%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Cianciolo%20Cosentino%20et%20al.%22%2C%22parsedDate%22%3A%222019-03-18%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BCianciolo%20Cosentino%2C%20C.%2C%20Berto%2C%20A.%2C%20Pelletier%2C%20S.%2C%20Hari%2C%20M.%2C%20Loffing%2C%20J.%2C%20Neuhauss%2C%20S.%20C.%20F.%2C%20%26amp%3B%20Doye%2C%20V.%20%282019%29.%20Moderate%20Nucleoporin%20133%20deficiency%20leads%20to%20glomerular%20damage%20in%20zebrafish.%20%26lt%3Bi%26gt%3BScientific%20Reports%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B9%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%204750.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41598-019-41202-4%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41598-019-41202-4%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Moderate%20Nucleoporin%20133%20deficiency%20leads%20to%20glomerular%20damage%20in%20zebrafish%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chiara%22%2C%22lastName%22%3A%22Cianciolo%20Cosentino%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandro%22%2C%22lastName%22%3A%22Berto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Pelletier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Michelle%22%2C%22lastName%22%3A%22Hari%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Johannes%22%2C%22lastName%22%3A%22Loffing%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Stephan%20C.%20F.%22%2C%22lastName%22%3A%22Neuhauss%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22Although%20structural%20nuclear%20pore%20proteins%20%28nucleoporins%29%20are%20seemingly%20required%20in%20every%20cell%20type%20to%20assemble%20a%20functional%20nuclear%20transport%20machinery%2C%20mutations%20or%20deregulation%20of%20a%20subset%20of%20them%20have%20been%20associated%20with%20specific%20human%20hereditary%20diseases.%20In%20particular%2C%20previous%20genetic%20studies%20of%20patients%20with%20nephrotic%20syndrome%20identified%20mutations%20in%20Nup107%20that%20impaired%20the%20expression%20or%20the%20localization%20of%20its%20direct%20partner%20at%20nuclear%20pores%2C%20Nup133.%20In%20the%20present%20study%2C%20we%20characterized%20the%20zebrafish%20nup133%20orthologous%20gene%20and%20its%20expression%20pattern%20during%20larval%20development.%20Using%20a%20morpholino-mediated%20gene%20knockdown%2C%20we%20show%20that%20partial%20depletion%20of%20Nup133%20in%20zebrafish%20larvae%20leads%20to%20the%20formation%20of%20kidney%20cysts%2C%20a%20phenotype%20that%20can%20be%20rescued%20by%20co-injection%20of%20wild%20type%20mRNA.%20Analysis%20of%20different%20markers%20for%20tubular%20and%20glomerular%20development%20shows%20that%20the%20overall%20kidney%20development%20is%20not%20affected%20by%20nup133%20knockdown.%20Likewise%2C%20no%20gross%20defect%20in%20nuclear%20pore%20complex%20assembly%20was%20observed%20in%20these%20nup133%20morphants.%20On%20the%20other%20hand%2C%20nup133%20downregulation%20results%20in%20proteinuria%20and%20moderate%20foot%20process%20effacement%2C%20mimicking%20some%20of%20the%20abnormalities%20typically%20featured%20by%20patients%20with%20nephrotic%20syndrome.%20These%20data%20indicate%20that%20nup133%20is%20a%20new%20gene%20required%20for%20proper%20glomerular%20structure%20and%20function%20in%20zebrafish.%22%2C%22date%22%3A%222019-03-18%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41598-019-41202-4%22%2C%22ISSN%22%3A%222045-2322%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A27%3A23Z%22%7D%7D%2C%7B%22key%22%3A%22HHSPUI9D%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Raich%20et%20al.%22%2C%22parsedDate%22%3A%222018-10-17%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BRaich%2C%20N.%2C%20Mahmoudi%2C%20S.%2C%20Emre%2C%20D.%2C%20%26amp%3B%20Karess%2C%20R.%20E.%20%282018%29.%20Mad1%20influences%20interphase%20nucleoplasm%20organization%20and%20chromatin%20regulation%20in%20Drosophila.%20%26lt%3Bi%26gt%3BOpen%20Biology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B8%26lt%3B%5C%2Fi%26gt%3B%2810%29%2C%20180166.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1098%5C%2Frsob.180166%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1098%5C%2Frsob.180166%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Mad1%20influences%20interphase%20nucleoplasm%20organization%20and%20chromatin%20regulation%20in%20Drosophila%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Natacha%22%2C%22lastName%22%3A%22Raich%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Souhir%22%2C%22lastName%22%3A%22Mahmoudi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Doruk%22%2C%22lastName%22%3A%22Emre%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Roger%20E.%22%2C%22lastName%22%3A%22Karess%22%7D%5D%2C%22abstractNote%22%3A%22The%20Drosophila%20Mad1%20spindle%20checkpoint%20protein%20helps%20organize%20several%20nucleoplasmic%20components%2C%20and%20flies%20lacking%20Mad1%20present%20changes%20in%20gene%20expression%20reflecting%20altered%20chromatin%20conformation.%20In%20interphase%2C%20checkpoint%20protein%20Mad1%20is%20usually%20described%20as%20localizing%20to%20the%20inner%20nuclear%20envelope%20by%20binding%20the%20nucleoporin%20Tpr%2C%20an%20interaction%20believed%20to%20contribute%20to%20proper%20mitotic%20regulation.%20Whether%20Mad1%20has%20other%20nuclear%20interphase%20functions%20is%20unknown.%20We%20found%20in%20Drosophila%20that%20Mad1%20is%20present%20in%20nuclei%20of%20both%20mitotic%20and%20postmitotic%20tissues.%20Three%20proteins%20implicated%20in%20various%20aspects%20of%20chromatin%20organization%20co-immunoprecipitated%20with%20Mad1%20from%20fly%20embryos%3A%20Mtor%5C%2FTpr%2C%20the%20SUMO%20peptidase%20Ulp1%20and%20Raf2%2C%20a%20subunit%20of%20a%20Polycomb-like%20complex.%20In%20primary%20spermatocytes%2C%20all%20four%20proteins%20colocalized%20in%20a%20previously%20undescribed%20chromatin-associated%20structure%20called%20here%20a%20MINT%20%28Mad1-containing%20IntraNuclear%20Territory%29.%20MINT%20integrity%20required%20all%20four%20proteins.%20In%20mad1%20mutant%20spermatocytes%2C%20the%20other%20proteins%20were%20no%20longer%20confined%20to%20chromatin%20domains%20but%20instead%20dispersed%20throughout%20the%20nucleoplasm.%20mad1%20flies%20also%20presented%20phenotypes%20indicative%20of%20excessive%20chromatin%20of%20heterochromatic%20character%20during%20development%20of%20somatic%20tissues.%20Together%20these%20results%20suggest%20that%20Drosophila%20Mad1%2C%20by%20helping%20organize%20its%20interphase%20protein%20partners%20in%20the%20nucleoplasm%2C%20contributes%20to%20proper%20chromatin%20regulation.%22%2C%22date%22%3A%222018-10-17%22%2C%22language%22%3A%22%22%2C%22DOI%22%3A%2210.1098%5C%2Frsob.180166%22%2C%22ISSN%22%3A%22%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Froyalsocietypublishing.org%5C%2Fdoi%5C%2F10.1098%5C%2Frsob.180166%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222023-07-31T14%3A57%3A32Z%22%7D%7D%2C%7B%22key%22%3A%22PE9BHLD9%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Souquet%20et%20al.%22%2C%22parsedDate%22%3A%222018-05-22%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BSouquet%2C%20B.%2C%20Freed%2C%20E.%2C%20Berto%2C%20A.%2C%20Andric%2C%20V.%2C%20Audug%26%23xE9%3B%2C%20N.%2C%20Reina-San-Martin%2C%20B.%2C%20Lacy%2C%20E.%2C%20%26amp%3B%20Doye%2C%20V.%20%282018%29.%20Nup133%20Is%20Required%20for%20Proper%20Nuclear%20Pore%20Basket%20Assembly%20and%20Dynamics%20in%20Embryonic%20Stem%20Cells.%20%26lt%3Bi%26gt%3BCell%20Reports%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B23%26lt%3B%5C%2Fi%26gt%3B%288%29%2C%202443%26%23×2013%3B2454.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.celrep.2018.04.070%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.celrep.2018.04.070%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Nup133%20Is%20Required%20for%20Proper%20Nuclear%20Pore%20Basket%20Assembly%20and%20Dynamics%20in%20Embryonic%20Stem%20Cells%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Benoit%22%2C%22lastName%22%3A%22Souquet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ellen%22%2C%22lastName%22%3A%22Freed%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandro%22%2C%22lastName%22%3A%22Berto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vedrana%22%2C%22lastName%22%3A%22Andric%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nicolas%22%2C%22lastName%22%3A%22Audug%5Cu00e9%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Bernardo%22%2C%22lastName%22%3A%22Reina-San-Martin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Elizabeth%22%2C%22lastName%22%3A%22Lacy%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22Nup133%20belongs%20to%20the%20Y-complex%2C%20a%20key%20component%20of%20the%20nuclear%20pore%20complex%20%28NPC%29%20scaffold.%20Studies%20on%20a%20null%20mutation%20in%20mice%20previously%20revealed%20that%20Nup133%20is%20essential%20for%20embryonic%20development%20but%5Cu00a0not%20for%20mouse%20embryonic%20stem%20cell%20%28mESC%29%20proliferation.%20Using%20single-pore%20detection%20and%20average%20NE-fluorescence%20intensity%2C%20we%20find%20that%20Nup133%20is%20dispensable%20for%20interphase%20and%20postmitotic%20NPC%20scaffold%20assembly%20in%20pluripotent%20mESCs.%20However%2C%20loss%20of%20Nup133%20specifically%20perturbs%20the%20formation%20of%20the%20nuclear%20basket%20as%20manifested%20by%20the%20absence%20of%20Tpr%20in%20about%20half%20of%20the%20NPCs%20combined%20with%20altered%20dynamics%20of%20Nup153.%20We%20further%20demonstrate%20that%20its%20central%20domain%20mediates%20Nup133%26%23039%3Bs%20role%20in%20assembling%20Tpr%20and%20Nup153%20into%20a%20properly%20configured%20nuclear%20basket.%20Our%20findings%20thus%20revisit%20the%20role%20of%20the%20Y-complex%20in%20pore%20biogenesis%20and%20provide%20insights%20into%20the%20interplay%20between%20NPC%20scaffold%20architecture%2C%20nuclear%20basket%20assembly%2C%20and%20the%20generation%20of%20heterogeneity%20among%20NPCs.%22%2C%22date%22%3A%222018-05-22%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.celrep.2018.04.070%22%2C%22ISSN%22%3A%222211-1247%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A27%3A49Z%22%7D%7D%2C%7B%22key%22%3A%22E7759ARZ%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Berto%20et%20al.%22%2C%22parsedDate%22%3A%222018-05%22%2C%22numChildren%22%3A4%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BBerto%2C%20A.%2C%20Yu%2C%20J.%2C%20Morchoisne-Bolhy%2C%20S.%2C%20Bertipaglia%2C%20C.%2C%20Vallee%2C%20R.%2C%20Dumont%2C%20J.%2C%20Ochsenbein%2C%20F.%2C%20Guerois%2C%20R.%2C%20%26amp%3B%20Doye%2C%20V.%20%282018%29.%20Disentangling%20the%20molecular%20determinants%20for%20Cenp-F%20localization%20to%20nuclear%20pores%20and%20kinetochores.%20%26lt%3Bi%26gt%3BEMBO%20Reports%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B19%26lt%3B%5C%2Fi%26gt%3B%285%29%2C%20e44742.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.15252%5C%2Fembr.201744742%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.15252%5C%2Fembr.201744742%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Disentangling%20the%20molecular%20determinants%20for%20Cenp-F%20localization%20to%20nuclear%20pores%20and%20kinetochores%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandro%22%2C%22lastName%22%3A%22Berto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jinchao%22%2C%22lastName%22%3A%22Yu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phanie%22%2C%22lastName%22%3A%22Morchoisne-Bolhy%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chiara%22%2C%22lastName%22%3A%22Bertipaglia%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Richard%22%2C%22lastName%22%3A%22Vallee%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julien%22%2C%22lastName%22%3A%22Dumont%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Francoise%22%2C%22lastName%22%3A%22Ochsenbein%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Raphael%22%2C%22lastName%22%3A%22Guerois%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22Cenp-F%20is%20a%20multifaceted%20protein%20implicated%20in%20cancer%20and%20developmental%20pathologies.%20The%20Cenp-F%20C-terminal%20region%20contains%20overlapping%20binding%20sites%20for%20numerous%20proteins%20that%20contribute%20to%20its%20functions%20throughout%20the%20cell%20cycle.%20Here%2C%20we%20focus%20on%20the%20nuclear%20pore%20protein%20Nup133%20that%20interacts%20with%20Cenp-F%20both%20at%20nuclear%20pores%20in%20prophase%20and%20at%20kinetochores%20in%20mitosis%2C%20and%20on%20the%20kinase%20Bub1%2C%20known%20to%20contribute%20to%20Cenp-F%20targeting%20to%20kinetochores.%20By%20combining%20in%20silico%20structural%20modeling%20and%20yeast%20two-hybrid%20assays%2C%20we%20generate%20an%20interaction%20model%20between%20a%20conserved%20helix%20within%20the%20Nup133%20%5Cu03b2-propeller%20and%20a%20short%20leucine%20zipper-containing%20dimeric%20segment%20of%20Cenp-F.%20We%20thereby%20create%20mutants%20affecting%20the%20Nup133%5C%2FCenp-F%20interface%20and%20show%20that%20they%20prevent%20Cenp-F%20localization%20to%20the%20nuclear%20envelope%2C%20but%20not%20to%20kinetochores.%20Conversely%2C%20a%20point%20mutation%20within%20an%20adjacent%20leucine%20zipper%20affecting%20the%20kinetochore%20targeting%20of%20Cenp-F%20KT-core%20domain%20impairs%20its%20interaction%20with%20Bub1%2C%20but%20not%20with%20Nup133%2C%20identifying%20Bub1%20as%20the%20direct%20KT-core%20binding%20partner%20of%20Cenp-F.%20Finally%2C%20we%20show%20that%20Cenp-E%20redundantly%20contributes%20together%20with%20Bub1%20to%20the%20recruitment%20of%20Cenp-F%20to%20kinetochores.%22%2C%22date%22%3A%222018-05%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.15252%5C%2Fembr.201744742%22%2C%22ISSN%22%3A%221469-3178%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A27%3A49Z%22%7D%7D%2C%7B%22key%22%3A%22L3Z9VEXR%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Martino%20et%20al.%22%2C%22parsedDate%22%3A%222017-10-23%22%2C%22numChildren%22%3A5%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BMartino%2C%20L.%2C%20Morchoisne-Bolhy%2C%20S.%2C%20Cheerambathur%2C%20D.%20K.%2C%20Van%20Hove%2C%20L.%2C%20Dumont%2C%20J.%2C%20Joly%2C%20N.%2C%20Desai%2C%20A.%2C%20Doye%2C%20V.%2C%20%26amp%3B%20Pintard%2C%20L.%20%282017%29.%20Channel%20Nucleoporins%20Recruit%20PLK-1%20to%20Nuclear%20Pore%20Complexes%20to%20Direct%20Nuclear%20Envelope%20Breakdown%20in%20C.%26%23xA0%3Belegans.%20%26lt%3Bi%26gt%3BDevelopmental%20Cell%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B43%26lt%3B%5C%2Fi%26gt%3B%282%29%2C%20157-171.e7.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.devcel.2017.09.019%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.devcel.2017.09.019%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Channel%20Nucleoporins%20Recruit%20PLK-1%20to%20Nuclear%20Pore%20Complexes%20to%20Direct%20Nuclear%20Envelope%20Breakdown%20in%20C.%5Cu00a0elegans%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lisa%22%2C%22lastName%22%3A%22Martino%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phanie%22%2C%22lastName%22%3A%22Morchoisne-Bolhy%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Dhanya%20K.%22%2C%22lastName%22%3A%22Cheerambathur%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lucie%22%2C%22lastName%22%3A%22Van%20Hove%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julien%22%2C%22lastName%22%3A%22Dumont%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nicolas%22%2C%22lastName%22%3A%22Joly%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Arshad%22%2C%22lastName%22%3A%22Desai%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lionel%22%2C%22lastName%22%3A%22Pintard%22%7D%5D%2C%22abstractNote%22%3A%22In%20animal%20cells%2C%20nuclear%20envelope%20breakdown%20%28NEBD%29%20is%20required%20for%20proper%20chromosome%20segregation.%20Whereas%20mitotic%20kinases%20have%20been%20implicated%20in%20NEBD%2C%20how%20they%20coordinate%20their%20activity%20to%20trigger%20this%20event%20is%20unclear.%20Here%2C%20we%20show%20that%20both%20in%20human%20cells%20and%20Caenorhabditis%20elegans%2C%20the%20Polo-like%20kinase%201%20%28PLK-1%29%20is%20recruited%20to%20the%20nuclear%20pore%20complexes%2C%20just%20prior%20to%20NEBD%2C%20through%20its%20Polo-box%20domain%20%28PBD%29.%20We%20provide%20evidence%20that%20PLK-1%20localization%20to%20the%20nuclear%20envelope%20%28NE%29%20is%20required%20for%20efficient%20NEBD.%20We%20identify%20the%20central%20channel%5Cu00a0nucleoporins%20NPP-1%5C%2FNup58%2C%20NPP-4%5C%2FNup54%2C%20and%20NPP-11%5C%2FNup62%20as%20the%20critical%20factors%20anchoring%20PLK-1%20to%20the%20NE%20in%20C.%5Cu00a0elegans.%20In%20particular%2C%20NPP-1%2C%20NPP-4%2C%20and%20NPP-11%20primed%20at%20multiple%20Polo-docking%20sites%20by%20Cdk1%20and%20PLK-1%20itself%20physically%20interact%20with%20the%20PLK-1%20PBD.%20We%20conclude%20that%20nucleoporins%20play%20an%20unanticipated%20regulatory%20role%20in%20NEBD%2C%20by%20recruiting%20PLK-1%20to%20the%20NE%20thereby%20facilitating%20phosphorylation%20of%20critical%20downstream%20targets.%22%2C%22date%22%3A%222017-10-23%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.devcel.2017.09.019%22%2C%22ISSN%22%3A%221878-1551%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22YZUD6P7F%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A28%3A03Z%22%7D%7D%5D%7D
Taniguchi, R., Orniacki, C., Kreysing, J. P., Zila, V., Zimmerli, C. E., Böhm, S., Turoňová, B., Kräusslich, H.-G., Doye, V., & Beck, M. (2025). Nuclear pores safeguard the integrity of the nuclear envelope.
Nature Cell Biology, 1–14.
https://doi.org/10.1038/s41556-025-01648-3
Dultz, E., & Doye, V. (2025). Opening the gate: Complexity and modularity of the nuclear pore scaffold and basket.
Current Opinion in Cell Biology,
92, 102461.
https://doi.org/10.1016/j.ceb.2024.102461
Nobari, P., Doye, V., & Boumendil, C. (2023). Metazoan nuclear pore complexes in gene regulation and genome stability.
DNA Repair,
130, 103565.
https://doi.org/10.1016/j.dnarep.2023.103565
Orniacki, C., Verrico, A., Pelletier, S., Souquet, B., Coulpier, F., Jourdren, L., Benetti, S., & Doye, V. (2023). Y-complex nucleoporins independently contribute to nuclear pore assembly and gene regulation in neuronal progenitors.
Journal of Cell Science, jcs.261151.
https://doi.org/10.1242/jcs.261151
Bouglita, W., Rabhi, S., Raich, N., Bouabid, C., Belghith, C., Slimani, O., Hkimi, C., Ghedira, K., Karess, R. E., Guizani-Tabbane, L., Attia, L., & Rabhi, I. (2022). Microbiological and molecular screening of Candida spp. isolated from genital tract of asymptomatic pregnant women.
Journal of Medical Microbiology,
71(9), 001589.
https://doi.org/10.1099/jmm.0.001589
Olley, G., Pradeepa, M. M., Grimes, G. R., Piquet, S., Polo, S. E., FitzPatrick, D. R., Bickmore, W. A., & Boumendil, C. (2021). Cornelia de Lange syndrome-associated mutations cause a DNA damage signalling and repair defect.
Nature Communications,
12(1), 3127.
https://doi.org/10.1038/s41467-021-23500-6
Gonzalez-Estevez, A., Verrico, A., Orniacki, C., Reina-San-Martin, B., & Doye, V. (2021). Integrity of the short arm of the nuclear pore Y-complex is required for mouse embryonic stem cell growth and differentiation.
Journal of Cell Science,
134(10), jcs258340.
https://doi.org/10.1242/jcs.258340
Raich, N., Contremoulins, V., & Karess, R. E. (2020). Immunostaining of Whole-Mount Drosophila Testes for 3D Confocal Analysis of Large Spermatocytes.
Journal of Visualized Experiments: JoVE,
162.
https://doi.org/10.3791/61061
Cianciolo Cosentino, C., Berto, A., Pelletier, S., Hari, M., Loffing, J., Neuhauss, S. C. F., & Doye, V. (2020). Publisher Correction: Moderate Nucleoporin 133 deficiency leads to glomerular damage in zebrafish.
Scientific Reports,
10(1), 3326.
https://doi.org/10.1038/s41598-020-58959-8
Cianciolo Cosentino, C., Berto, A., Pelletier, S., Hari, M., Loffing, J., Neuhauss, S. C. F., & Doye, V. (2020). Author Correction: Moderate Nucleoporin 133 deficiency leads to glomerular damage in zebrafish.
Scientific Reports,
10(1), 756.
https://doi.org/10.1038/s41598-020-57829-7
Menant, A., & Karess, R. E. (2020). Mutations in the Drosophila rough deal gene affecting RZZ kinetochore function.
Biology of the Cell,
112(10), 300–315.
https://doi.org/10.1111/boc.201900105
Cianciolo Cosentino, C., Berto, A., Pelletier, S., Hari, M., Loffing, J., Neuhauss, S. C. F., & Doye, V. (2019). Moderate Nucleoporin 133 deficiency leads to glomerular damage in zebrafish.
Scientific Reports,
9(1), 4750.
https://doi.org/10.1038/s41598-019-41202-4
Raich, N., Mahmoudi, S., Emre, D., & Karess, R. E. (2018). Mad1 influences interphase nucleoplasm organization and chromatin regulation in Drosophila.
Open Biology,
8(10), 180166.
https://doi.org/10.1098/rsob.180166
Souquet, B., Freed, E., Berto, A., Andric, V., Audugé, N., Reina-San-Martin, B., Lacy, E., & Doye, V. (2018). Nup133 Is Required for Proper Nuclear Pore Basket Assembly and Dynamics in Embryonic Stem Cells.
Cell Reports,
23(8), 2443–2454.
https://doi.org/10.1016/j.celrep.2018.04.070
Berto, A., Yu, J., Morchoisne-Bolhy, S., Bertipaglia, C., Vallee, R., Dumont, J., Ochsenbein, F., Guerois, R., & Doye, V. (2018). Disentangling the molecular determinants for Cenp-F localization to nuclear pores and kinetochores.
EMBO Reports,
19(5), e44742.
https://doi.org/10.15252/embr.201744742
Martino, L., Morchoisne-Bolhy, S., Cheerambathur, D. K., Van Hove, L., Dumont, J., Joly, N., Desai, A., Doye, V., & Pintard, L. (2017). Channel Nucleoporins Recruit PLK-1 to Nuclear Pore Complexes to Direct Nuclear Envelope Breakdown in C. elegans.
Developmental Cell,
43(2), 157-171.e7.
https://doi.org/10.1016/j.devcel.2017.09.019
Revues
2913254
DCUT52C8
1
apa
50
date
desc
8019
https://www.ijm.fr/wp-content/plugins/zotpress/
%7B%22status%22%3A%22success%22%2C%22updateneeded%22%3Afalse%2C%22instance%22%3Afalse%2C%22meta%22%3A%7B%22request_last%22%3A0%2C%22request_next%22%3A0%2C%22used_cache%22%3Atrue%7D%2C%22data%22%3A%5B%7B%22key%22%3A%22L6RJID2H%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22lastModifiedByUser%22%3A%7B%22id%22%3A11274337%2C%22username%22%3A%22Charlotte_Brancaz%22%2C%22name%22%3A%22%22%2C%22links%22%3A%7B%22alternate%22%3A%7B%22href%22%3A%22https%3A%5C%2F%5C%2Fwww.zotero.org%5C%2Fcharlotte_brancaz%22%2C%22type%22%3A%22text%5C%2Fhtml%22%7D%7D%7D%2C%22creatorSummary%22%3A%22Berto%20and%20Doye%22%2C%22parsedDate%22%3A%222018%22%2C%22numChildren%22%3A3%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BBerto%2C%20A.%2C%20%26amp%3B%20Doye%2C%20V.%20%282018%29.%20Regulation%20of%20Cenp-F%20localization%20to%20nuclear%20pores%20and%20kinetochores.%20%26lt%3Bi%26gt%3BCell%20Cycle%20%28Georgetown%2C%20Tex.%29%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B17%26lt%3B%5C%2Fi%26gt%3B%2817%29%2C%202122%26%23×2013%3B2133.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1080%5C%2F15384101.2018.1520569%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1080%5C%2F15384101.2018.1520569%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Regulation%20of%20Cenp-F%20localization%20to%20nuclear%20pores%20and%20kinetochores%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandro%22%2C%22lastName%22%3A%22Berto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9rie%22%2C%22lastName%22%3A%22Doye%22%7D%5D%2C%22abstractNote%22%3A%22In%20metazoans%2C%20the%20assembly%20of%20kinetochores%20on%20centrometric%20chromatin%20and%20the%20dismantling%20of%20nuclear%20pore%20complexes%20are%20processes%20that%20have%20to%20be%20tightly%20coordinated%20to%20ensure%20the%20proper%20assembly%20of%20the%20mitotic%20spindle%20and%20a%20successful%20mitosis.%20It%20is%20therefore%20noteworthy%20that%20these%20two%20macromolecular%20assemblies%20share%20a%20subset%20of%20constituents.%20One%20of%20these%20multifaceted%20components%20is%20Cenp-F%2C%20a%20protein%20implicated%20in%20cancer%20and%20developmental%20pathologies.%20During%20the%20cell%20cycle%2C%20Cenp-F%20localizes%20in%20multiple%20cellular%20structures%20including%20the%20nuclear%20envelope%20in%20late%20G2%5C%2Fearly%20prophase%20and%20kinetochores%20throughout%20mitosis.%20We%20recently%20characterized%20the%20molecular%20determinants%20of%20Cenp-F%20interaction%20with%20Nup133%2C%20a%20structural%20nuclear%20pore%20constituent.%20In%20parallel%20with%20two%20other%20independent%20studies%2C%20we%20further%20elucidated%20the%20mechanisms%20governing%20Cenp-F%20kinetochore%20recruitment%20that%20mainly%20relies%20on%20its%20interaction%20with%20Bub1%2C%20with%20redundant%20contribution%20of%20Cenp-E%20upon%20acute%20microtubule%20depolymerisation.%20Here%20we%20synthesize%20the%20current%20literature%20regarding%20the%20dual%20location%20of%20Cenp-F%20at%20nuclear%20pores%20and%20kinetochores%20and%20extend%20our%20discussion%20to%20the%20regulation%20of%20these%20NPC%20and%20kinetochore%20localizations%20by%20mitotic%20kinase%20and%20spindle%20microtubules.%22%2C%22date%22%3A%222018%22%2C%22language%22%3A%22eng%22%2C%22DOI%22%3A%2210.1080%5C%2F15384101.2018.1520569%22%2C%22ISSN%22%3A%221551-4005%22%2C%22url%22%3A%22%22%2C%22collections%22%3A%5B%22DCUT52C8%22%5D%2C%22dateModified%22%3A%222022-09-05T13%3A27%3A35Z%22%7D%7D%5D%7D
Berto, A., & Doye, V. (2018). Regulation of Cenp-F localization to nuclear pores and kinetochores.
Cell Cycle (Georgetown, Tex.),
17(17), 2122–2133.
https://doi.org/10.1080/15384101.2018.1520569
Thèses
Clarisse Orniacki (01/10/2018 – 12/12/2022) – Université Paris Cité.
[ les nucléoporines du complexe Y dans la différenciation des cellules souches embryonnaires: impact sur l’intégrité des pores nucléaires et la régulation des gènes]
Y-complex nucleoporins in embryonic stem cell differentiation; impact on nuclear pore integrity and gene regulation
Alba Gonzalez-Estevez (01/10/2016 – 19/12/2019) – Université Paris Diderot
[À la frontière entre division et différenciation cellulaire : rôle de Seh1 dans les cellules souches embryonnaires de souris]
On the edge between cell division and cell differentiation: role of Seh1 in mouse embryonic stem cells
Alessandro Berto (01/10/2013 – 11/12/2017) – Université Paris-Saclay
[Implication de la sous-unité Nup133 des pores nucléaires dans la division et la différenciation cellulaires : partenaires et mécanismes]
Implication of the Nup133 subunit of nuclear pores in cell division and differentiation: partners and mechanisms
Aurélie Floch (01/10/2010 – 26/09/2014) – Université Paris-Sud
Mécanismes d’adressage de Pom33, protéine transmembranaire associée aux pores nucléaires chez la levure Saccharomyces cerevisiae
Anne CHADRIN (01/10/2006 – 02/07/2010) -Université Paris XI
Analyses fonctionnelles d’une nouvelle protéine de l’enveloppe nucléaire chez la levure Saccharomyces cerevisiae
Michela ZUCCOLO (01/09/2005- 19/07/2008) -Université Paris XI
Implication du complexe Nup107-160 des pores nucléaires dans l’entrée, la progression et la sortie de mitose.
Annabelle Alves (01/09/2001- 01/07/2005) -Université Paris XI- Orsay
Analyse fonctionnelle du complexe NUP107-160 des pores nucléaires au cours du cycle cellulaire des vertébrés
Siau Wei BAï (01/09/2000 – 10/12/2004)- Université Paris XI- Orsay
Caractérisation fonctionnele du complexe Nup107: un sous-complexe protéique du pore nucléaire chez la levure Schizoszaccharomyces pombe
Naïma BELGAREH (01/09/ 1995- 27/09/1999) – Université Paris VI
Etude de l’assemblage et de la dynamique des pores nucléaires
Collaborations
Collaborations en cours :
- Martin BECK, Max Planck Insitute of Biophysics, Frankfurt, Germany
- Corinne ANTIGNAC et Géraldine MOLLET, Institut Image, Paris, France;
- Brian BURKE, IMB, A*Star, Singapore;
- Andreas SCHEDL, Institut de Biologie Valrose, Nice, France;
- Fanny COULPIER and Laurent JOURDREN, Genomics facility, IBENS, Paris, France
Collaborations antérieures :
- Johannes LOFFING and Stephan C. F. NEUHAUSS, University of Zurich, Switzerland;
- Bernardo REINA−SAN−MARTIN, IGBMC, Illkirch, France;
- Elizabeth LACY, Memorial Sloan Kettering Cancer Center, New York, USA;
- Raphael GUEROIS, Institut de Biologie et de Technologies de Saclay (iBiTec-S), Gif-sur-Yvette, France;
- Richard VALLEE – Department of Pathology and Cell Biology, Columbia University, New York, USA;
- Julien DUMONT, Institut Jacques-Monod IJM, Paris, France;
- Lionel PINTARD, Institut Jacques-Monod IJM, Paris, France
Financement
L’équipe a été labellisée « équipe FRM 2020 » par la Fondation pour la Recherche Médicale et a obtenu en 2019 une subvention de l’IDEX Université de Paris. L’équipe a été soutenue par le Labex « Who am I? » et l’ANR, et accueille actuellement dans ses locaux les membres de la plateforme « enSCORE » dédiée à la production d’organoïdes neuraux , fondée par le Labex « »Who am I? »



Actualités
Offre d'emploi
 Figure 1: Représentation schématique d’un pore nucléaire et des nucléoporines qui composent le Y-complexe.
Figure 1: Représentation schématique d’un pore nucléaire et des nucléoporines qui composent le Y-complexe.
 Figure 3: Cryosection d’un organoïde cérébral au jour 38 de différenciation
Figure 3: Cryosection d’un organoïde cérébral au jour 38 de différenciation Brigitte BUENDIA, Researcher, DOYE LAB+33 (0)1 57 27 80 60, bureau 344B
Brigitte BUENDIA, Researcher, DOYE LAB+33 (0)1 57 27 80 60, bureau 344B Roger KARESS, Emeritus researcher, DOYE LAB+33 (0)1 57 27 80 95, bureau 344B
Roger KARESS, Emeritus researcher, DOYE LAB+33 (0)1 57 27 80 95, bureau 344B Stephanie MORCHOISNE, Biology engineer, DOYE LAB+33 (0)1 57 27 80 61, bureau 342B
Stephanie MORCHOISNE, Biology engineer, DOYE LAB+33 (0)1 57 27 80 61, bureau 342B Ona PRAT PLANAS, PhD student, DOYE LAB+33 (0)1 57 27 80 62, bureau 342B
Ona PRAT PLANAS, PhD student, DOYE LAB+33 (0)1 57 27 80 62, bureau 342B Nathalie VADROT, Biology engineer, DOYE LAB+33 (0)1 57 27 80 61, bureau 342B
Nathalie VADROT, Biology engineer, DOYE LAB+33 (0)1 57 27 80 61, bureau 342B Cassandra VORMS, Intern, DOYE LAB+33 (0)1 57 27 80 62, bureau 342B
Cassandra VORMS, Intern, DOYE LAB+33 (0)1 57 27 80 62, bureau 342B