Recherche
Nos recherches portent principalement sur le développement de la moelle épinière et du cerveau postérieur (rhombencéphale).
Nos objectifs sont de :
- Élucider la dynamique des voies de signalisation et des programmes transcriptionnels qui orchestrent la morphogenèse du tube neural et guident l’émergence des diverses populations de progéniteurs et de neurones à l’origine des circuits sensoriels et moteurs.
- Déchiffrer comment certaines mutations génétiques rares perturbent ces processus de développement, entraînant des défauts de fermeture du tube neural, des cancers pédiatriques — en particulier la rhabdomyosarcome — ainsi que des maladies des motoneurones telles que l’amyotrophie spinale (SMA) et la sclérose latérale amyotrophique (SLA).
Axe 1: PAX3/7 et BMPs & Régulation spatiale des destins et des morphologies cellulaires.
Les facteurs de transcription paralogues PAX3 et PAX7 peuvent agir à la fois comme activateurs et répresseurs transcriptionnels. Cette dualité fonctionnelle des PAX est modulée le long de l’axe dorso-ventral de la moelle épinière embryonnaire, par le gradient de signalisation par les BMPs, avec chacune des fonctionnalités déterminant des destins cellulaires et des morphologies spécifiques. Nous cherchons à décrypter comment cette activité bivalente est intégrée au niveau du génome, en analysant le recrutement des PAX et de leurs partenaires, ainsi que les dynamiques de la chromatine qui y sont associées. Parallèlement, nous étudions comment les réseaux de gènes régulés par les PAX orchestrent leurs effets sur le destin cellulaire, la morphologie et les propriétés mécaniques du neuroépithélium. Ces recherches visent à mieux comprendre comment des mutations touchant les PAX ou les gènes de leurs réseaux peuvent engendrer des défauts de fermeture du tube neural et de neurogenèse, à l’origine d’une pathologie congénitale majeure : le spina bifida.
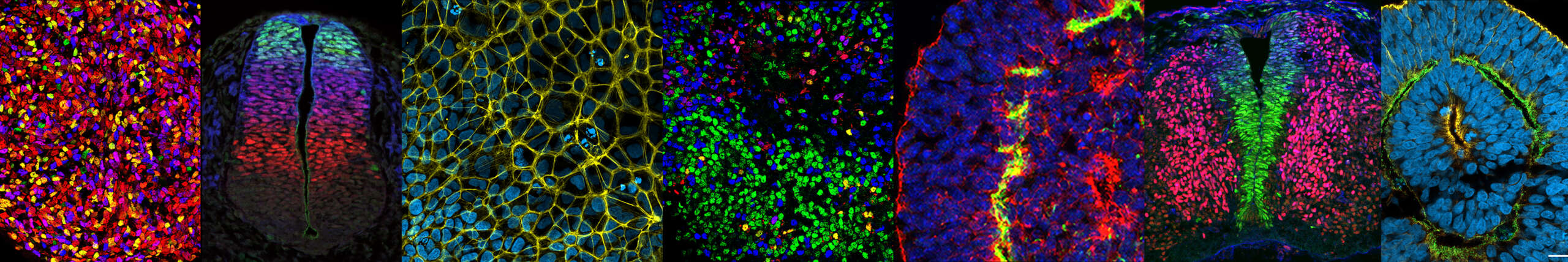
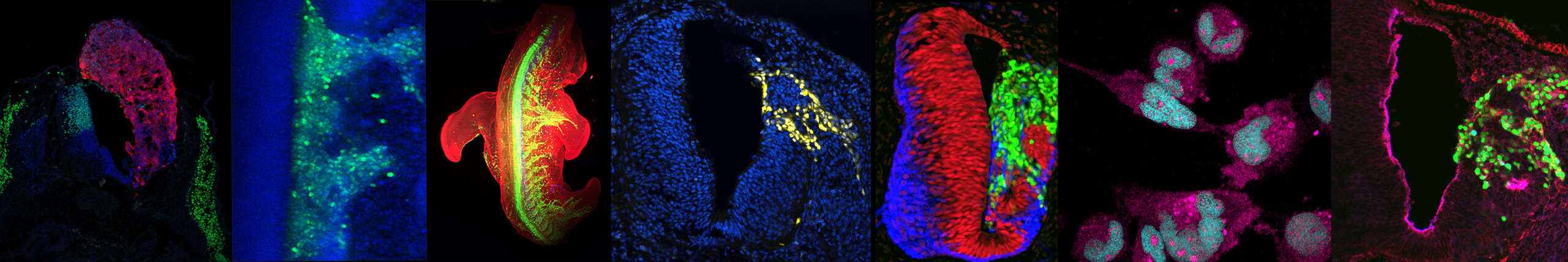
Axe 2: Dynamiques de signalisation et spécification de la diversité neuronale du cerveau postérieur et de la moelle épinière
En utilisant la différenciation dirigée de cellules souches pluripotentes humaines (hPSCs) et des modèles d’organoïdes que nous avons développés au fil des années, nous étudions les voies de transduction du signal et les réseaux génétiques qui contrôlent la coordination de la morphogenèse et de la régionalisation du tube neural. Ce couplage est essentiel à la formation de circuits locomoteurs distincts le long de l’axe du corps (Nedelec, Martinez-Arias, Curr. Opin. Neurobiol., 2021).
Nous avons développé une nouvelle stratégie pour étudier les mécanismes de spécification cellulaire via la différenciation in vitro de hPSCs (Maury et al., Nature Biotechnology, 2015), permettant la spécification efficace des progéniteurs du tronc cérébral et de la moelle épinière, ainsi que leur différenciation en motoneurones spinaux et crâniaux — des types cellulaires présentant une vulnérabilité différentielle selon les pathologies. Ces modèles nous ont permis de mettre en évidence des mécanismes régulant la dynamique de l’expression séquentielle des gènes HOX, les gènes régulateurs maîtres de la diversification des circuits moteurs le long de l’axe antéro-postérieur.
Ce travail a conduit au développement des premières méthodes efficaces pour générer des sous-types de motoneurones distincts, différemment affectés dans les maladies des motoneurones (Mouilleau, Vaslin et al., Development, 2021).
En étudiant les mécanismes qui régulent le destin des progéniteurs axiaux et leur potentiel morphogénétique, nous avons récemment identifié des voies de signalisation clés impliquées dans la co-morphogenèse et la régionalisation synchronisée du tube neural et des somites. Cela a permis la génération in vitro de structures humaines ressemblant au tronc embryonnaire, modélisant la morphogenèse de l’axe corporel en développement, et a conduit à l’identification de voies contrôlant la morphogenèse du tube neural.
Ces travaux montrent également que les modèles auto-organisés à partir de cellules souches peuvent reproduire une morphogenèse multi-tissulaire ainsi qu’une organisation topographique des types cellulaires terminaux — des caractéristiques absentes de la plupart des organoïdes actuels. Ils ouvrent la voie à une nouvelle génération de modèles de l’organogenèse humaine, et à l’étude du développement et du fonctionnement des circuits sensoriels et moteurs (Gribaudo et al., Nature Biotechnology, 2024).
Projets en cours dans cet axe
1. Synchronisation de la morphogenèse et de la régionalisation de l’axe antéro-postérieur
Comment la morphogenèse de l’axe antéro-postérieur est-elle synchronisée avec sa régionalisation pour garantir le positionnement correcte des types cellulaires ?
Nous utilisons des perturbations des dynamiques des voies de signalisation et des approches génomiques (RNA-seq, ATAC-seq, CUT&Tag) pour étudier comment les signaux extrinsèques impliqués dans l’allongement de l’axe embryonnaire régulent aussi l’induction des gènes HOX. Nous cherchons également à comprendre comment le rythme d’activation des HOX se traduit en motifs d’expression spatiaux permettant de positionner différents sous-types neuronaux le long de l’axe.
2. Spécification de la diversité des motoneurones humains
Le corps humain compte plus de 300 muscles squelettiques distincts, chacun innervé par un pool moteur — un groupe dédié de motoneurones. Pourtant, notre compréhension des mécanismes assurant cette diversification neuronale, en particulier chez l’humain, reste limitée, ce qui a des conséquences importantes sur la validité des modèles in vitro pour entre autres étudier les maladies affectant les neurones moteurs.
En combinant des analyses génomiques en cellule unique et histologiques sur organoïdes et tissus embryonnaires, nous étudions les signaux intrinsèques et extrinsèques qui pilotent la formation de la diversité neuronale spinale, en nous concentrant initialement sur la spécification des sous-types de motoneurones qui controlent les muscles du corps.
Axe 3 : Bases cellulaires et moléculaires de maladie du motoneurons
Ces modèles in vitro permettent d’accéder à des tissus ou des types cellulaires humains affectés dans des maladies. Nous utilisons donc des cellules souches pluripotentes induites dérivées de patients et ces modèles d’embryogenèse in vitro pour étudier les bases des maladies des motoneurones, un groupe hétérogène de maladies incurables et souvent mortelles. Nous étudions en particulier les atrophies musculaires spinales (SMAs) infantiles qui, bien que provoquées par des mutations dans des gènes exprimés de manière ubiquitaire, sont liées à des défauts de formation ou de survie de populations particulières de motoneurones tandis que d’autres sont préservées. Décrypter les bases de la vulnérabilité ou de la résistance de ces différents types de motoneurones pourrait ouvrir de nouvelles pistes thérapeutiques. Grâce à ces approches, nous commençons un projet sur la sclérose latérale amyotrophique en collaboration avec Odil Porrua.
Axe 4 : Détournement des signaux neurodéveloppementaux dans le rhabdomyosarcome
Le déploiement ectopique des voies de signalisation développementales dans les cancers pédiatriques, y compris le rhabdomyosarcome, pourrait expliquer leur évolution rapide sans accumulation des aberrations proto-oncogéniques typiques. Dans ce projet, nous évaluons le potentiel des cellules neuronales à donner naissance à des néoplasies rappelant le rhabdomyosarcome. En collaboration avec M. Castets (CRCL) et E. Pasquier (CRCM), nous étudions le rôle des signaux neurodéveloppementaux dans l’émergence de ce cancer et explorons la possibilité de cibler ces signaux pour induire une sensibilité des cellules de rhabdomyosarcome aux chimiothérapies déjà disponibles.
Membres
Responsables
Stephane NEDELEC,
Researcher,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 91, bureau 583B
Vanessa RIBES,
Researcher,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Membres
Asna ABDOU,
Biology engineer,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Ada ALLAM,
Postdoctoral researcher,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Marine ALVES,
Biology engineer,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Kenza CHERIET,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Lucas DENIS,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Claire DUGAST,
Assistant Professor,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Pascale GILARDI HEBENSTREIT,
Researcher,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Marine GRISON,
Biology engineer,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Grace HENSTONE,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Theaud HEZEZ,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Helena MALEK,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Camil MIRDASS,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Carla RODRIGUEZ-VILLA,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Robin RONDON,
PhD student,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Manon SAEZ,
Intern,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Elisa SPIELMANN,
Biology engineer,
RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr

Sélection de publication
Dual transcriptional activities of PAX3 and PAX7 spatially encode spinal cell fates through distinct gene networks. Rondon, R., Hezez, T., Albert, J. R., Hayashi, S., Drayton-Libotte, B., Curto, G. G., Auradé, F., Balloul, E., Dugast-Darzacq, C., Relaix, F., Gilardi-Hebenstreit, P., & Ribes, V. (2025). . PLOS Biology, 23(10), e3003448. https://doi.org/10.1371/journal.pbio.3003448
Stem cell-derived models of spinal neurulation. Mirdass C, Catala M, Bocel M, Nedelec S, Ribes V. Emerg Top Life Sci. 2023 Dec 18;7(4):423-437. doi: 10.1042/ETLS20230087. PMID: 38087891 Review.
Self-organizing models of human trunk organogenesis recapitulate spinal cord and spine co-morphogenesis. Gribaudo S, Robert R, van Sambeek B, Mirdass C, Lyubimova A, Bouhali K, Ferent J, Morin X, van Oudenaarden A, Nedelec S. Nat Biotechnol. 2024 Aug;42(8):1243-1253. doi: 10.1038/s41587-023-01956-9. Epub 2023 Sep 14. PMID: 37709912
Single-cell transcriptomic analysis reveals diversity within mammalian spinal motor neurons. Liau ES, Jin S, Chen YC, Liu WS, Calon M, Nedelec S, Nie Q, Chen JA. Nat Commun. 2023 Jan 3;14(1):46. doi: 10.1038/s41467-022-35574-x. PMID: 36596814 Free PMC article.
Dynamic extrinsic pacing of the HOX clock in human axial progenitors controls motor neuron subtype specification. Mouilleau V, Vaslin C, Robert R, Gribaudo S, Nicolas N, Jarrige M, Terray A, Lesueur L, Mathis MW, Croft G, Daynac M, Rouiller-Fabre V, Wichterle H, Ribes V, Martinat C, Nedelec S. Development. 2021 Mar 29;148(6):dev194514. doi: 10.1242/dev.194514.
The PAX-FOXO1s trigger fast trans-differentiation of chick embryonic neural cells into alveolar rhabdomyosarcoma with tissue invasive properties limited by S phase entry inhibition. Gonzalez Curto G, Der Vartanian A, Frarma YE, Manceau L, Baldi L, Prisco S, Elarouci N, Causeret F, Korenkov D, Rigolet M, Aurade F, De Reynies A, Contremoulins V, Relaix F, Faklaris O, Briscoe J, Gilardi-Hebenstreit P, Ribes V. PLoS Genet. 2020 Nov 11;16(11):e1009164. doi: 10.1371/journal.pgen.1009164.
In vitro models of spinal motor circuit’s development in mammals: achievements and challenges. Nedelec S, Martinez-Arias A. Curr Opin Neurobiol. 2021 Feb;66:240-249. doi: 10.1016/j.conb.2020.12.002. Epub 2021 Mar 5. PMID: 33677159 Review.
Dullard-mediated Smad1/5/8 inhibition controls mouse cardiac neural crest cells condensation and outflow tract septation. Darrigrand JF, Valente M, Comai G, Martinez P, Petit M, Nishinakamura R, Osorio DS, Renault G, Marchiol C, Ribes V, Cadot B. Elife. 2020 Feb 27;9:e50325. doi: 10.7554/eLife.50325.
BMP4 patterns Smad activity and generates stereotyped cell fate organization in spinal organoids. Duval N, Vaslin C, Barata TC, Frarma Y, Contremoulins V, Baudin X, Nedelec S, Ribes VC. Development. 2019 Jul 25;146(14):dev175430. doi: 10.1242/dev.175430.
Pax3- and Pax7-mediated Dbx1 regulation orchestrates the patterning of intermediate spinal interneurons. Gard C, Gonzalez Curto G, Frarma YE, Chollet E, Duval N, Auzié V, Auradé F, Vigier L, Relaix F, Pierani A, Causeret F, Ribes V. Dev Biol. 2017 Dec 1;432(1):24-33. doi: 10.1016/j.ydbio.2017.06.014.
Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Maury Y, Côme J, Piskorowski RA, Salah-Mohellibi N, Chevaleyre V, Peschanski M, Martinat C, Nedelec S. Nat Biotechnol. 2015 Jan;33(1):89-96. doi: 10.1038/nbt.3049. Epub 2014 Nov 10. PMID: 25383599
Publications
Publications
2913254
MIYUW3RH
1
apa
50
date
desc
8845
https://www.ijm.fr/wp-content/plugins/zotpress/
%7B%22status%22%3A%22success%22%2C%22updateneeded%22%3Afalse%2C%22instance%22%3Afalse%2C%22meta%22%3A%7B%22request_last%22%3A0%2C%22request_next%22%3A0%2C%22used_cache%22%3Atrue%7D%2C%22data%22%3A%5B%7B%22key%22%3A%22Q38MJNFC%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Rondon%20et%20al.%22%2C%22parsedDate%22%3A%222025-10-24%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BRondon%2C%20R.%2C%20Hezez%2C%20T.%2C%20Albert%2C%20J.%20R.%2C%20Hayashi%2C%20S.%2C%20Drayton-Libotte%2C%20B.%2C%20Curto%2C%20G.%20G.%2C%20Aurad%26%23xE9%3B%2C%20F.%2C%20Balloul%2C%20E.%2C%20Dugast-Darzacq%2C%20C.%2C%20Relaix%2C%20F.%2C%20Gilardi-Hebenstreit%2C%20P.%2C%20%26amp%3B%20Ribes%2C%20V.%20%282025%29.%20Dual%20transcriptional%20activities%20of%20PAX3%20and%20PAX7%20spatially%20encode%20spinal%20cell%20fates%20through%20distinct%20gene%20networks.%20%26lt%3Bi%26gt%3BPLOS%20Biology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B23%26lt%3B%5C%2Fi%26gt%3B%2810%29%2C%20e3003448.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1371%5C%2Fjournal.pbio.3003448%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1371%5C%2Fjournal.pbio.3003448%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Dual%20transcriptional%20activities%20of%20PAX3%20and%20PAX7%20spatially%20encode%20spinal%20cell%20fates%20through%20distinct%20gene%20networks%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Robin%22%2C%22lastName%22%3A%22Rondon%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Th%5Cu00e9aud%22%2C%22lastName%22%3A%22Hezez%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julien%20Richard%22%2C%22lastName%22%3A%22Albert%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Shinichiro%22%2C%22lastName%22%3A%22Hayashi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Bernadette%22%2C%22lastName%22%3A%22Drayton-Libotte%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gloria%20Gonzalez%22%2C%22lastName%22%3A%22Curto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Aurad%5Cu00e9%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Elie%22%2C%22lastName%22%3A%22Balloul%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Claire%22%2C%22lastName%22%3A%22Dugast-Darzacq%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Relaix%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pascale%22%2C%22lastName%22%3A%22Gilardi-Hebenstreit%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%5D%2C%22abstractNote%22%3A%22Understanding%20how%20transcription%20factors%20regulate%20organized%20cellular%20diversity%20in%20developing%20tissues%20remains%20a%20major%20challenge%20due%20to%20their%20pleiotropic%20functions.%20We%20addressed%20this%20by%20monitoring%20and%20genetically%20modulating%20the%20activity%20of%20PAX3%20and%20PAX7%20during%20the%20specification%20of%20neural%20progenitor%20pools%20in%20the%20embryonic%20spinal%20cord.%20Using%20mouse%20models%2C%20we%20show%20that%20the%20balance%20between%20the%20transcriptional%20activating%20and%20repressing%20functions%20of%20these%20factors%20is%20modulated%20along%20the%20dorsoventral%20axis%20and%20is%20instructive%20to%20the%20patterning%20of%20spinal%20progenitor%20pools.%20By%20combining%20loss-of-function%20experiments%20with%20functional%20genomics%20in%20spinal%20organoids%2C%20we%20demonstrate%20that%20PAX-mediated%20repression%20and%20activation%20rely%20on%20distinct%20cis-regulatory%20genomic%20modules.%20This%20enables%20both%20the%20coexistence%20of%20their%20dual%20activity%20in%20dorsal%20cell%20progenitors%20and%20the%20specific%20control%20of%20two%20major%20differentiation%20programs.%20PAX%20promote%20H3K27me3%20deposition%20at%20silencers%20to%20repress%20ventral%20identities%2C%20while%20at%20enhancers%2C%20they%20act%20as%20pioneer%20factors%2C%20opening%20and%20activating%20cis-regulatory%20modules%20to%20specify%20dorsal-most%20identities.%20Finally%2C%20we%20show%20that%20this%20pioneer%20activity%20is%20restricted%20to%20cells%20exposed%20to%20BMP%20morphogens%2C%20ensuring%20spatial%20specificity.%20These%20findings%20reveal%20how%20PAX%20proteins%2C%20modulated%20by%20morphogen%20gradients%2C%20orchestrate%20neuronal%20diversity%20in%20the%20spinal%20cord%2C%20providing%20a%20robust%20framework%20for%20neural%20subtype%20specification.%22%2C%22date%22%3A%2224%20oct.%202025%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1371%5C%2Fjournal.pbio.3003448%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fjournals.plos.org%5C%2Fplosbiology%5C%2Farticle%3Fid%3D10.1371%5C%2Fjournal.pbio.3003448%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221545-7885%22%2C%22language%22%3A%22en%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-10-28T10%3A46%3A06Z%22%7D%7D%2C%7B%22key%22%3A%22Y4ZFJDPF%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Paillard%20et%20al.%22%2C%22parsedDate%22%3A%222025-07-30%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BPaillard%2C%20T.%2C%20Allam%2C%20A.%2C%20Doulazmi%2C%20M.%2C%20Hautefeuille%2C%20M.%2C%20Fouquet%2C%20C.%2C%20Sarde%2C%20L.%2C%20Stoufflet%2C%20J.%2C%20Messaoudi%2C%20S.%2C%20Spassky%2C%20N.%2C%20N%26%23xE9%3Bd%26%23xE9%3Blec%2C%20S.%2C%20Dusart%2C%20I.%2C%20Trembleau%2C%20A.%2C%20%26amp%3B%20Isabelle%20Caill%26%23xE9%3B.%20%282025%29.%20GPR161%20mechanosensitivity%20at%20the%20primary%20cilium%20drives%20neuronal%20saltatory%20migration.%20%26lt%3Bi%26gt%3BScience%20Advances%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B11%26lt%3B%5C%2Fi%26gt%3B%2831%29%2C%20eadx3846.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1126%5C%2Fsciadv.adx3846%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1126%5C%2Fsciadv.adx3846%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22GPR161%20mechanosensitivity%20at%20the%20primary%20cilium%20drives%20neuronal%20saltatory%20migration%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Th%5Cu00e9o%22%2C%22lastName%22%3A%22Paillard%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ada%22%2C%22lastName%22%3A%22Allam%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mohamed%22%2C%22lastName%22%3A%22Doulazmi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mathieu%22%2C%22lastName%22%3A%22Hautefeuille%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Coralie%22%2C%22lastName%22%3A%22Fouquet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Liza%22%2C%22lastName%22%3A%22Sarde%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julie%22%2C%22lastName%22%3A%22Stoufflet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Salima%22%2C%22lastName%22%3A%22Messaoudi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nathalie%22%2C%22lastName%22%3A%22Spassky%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22N%5Cu00e9d%5Cu00e9lec%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Isabelle%22%2C%22lastName%22%3A%22Dusart%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alain%22%2C%22lastName%22%3A%22Trembleau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22%22%2C%22lastName%22%3A%22Isabelle%20Caill%5Cu00e9%22%7D%5D%2C%22abstractNote%22%3A%22The%20saltatory%20migration%20of%20neurons%20is%20essential%20for%20brain%20formation.%20Whether%20mechanical%20stimuli%20regulate%20this%20process%20is%20unknown.%20Here%2C%20we%20show%20that%20the%20primary%20cilium%20acts%20as%20a%20mechanical%20sensor%20through%20GPR161.%20Using%20an%20ex%20vivo%20neuronal%20migration%20model%20and%20microfluidic%20assays%2C%20we%20demonstrate%20that%20fluid%20shear%20stress%20induces%20migration%20via%20the%20mechanoreceptor%20GPR161%20at%20the%20primary%20cilium%2C%20with%20its%20mechanosensitive%20helix%208%20being%20essential.%20We%20demonstrate%20that%20GPR161%20activates%20a%20recently%20discovered%20cAMP%5C%2FPKA%20signaling%20pathway%20leading%20to%20the%20phosphorylation%20of%20NDE1%2C%20a%20dynein%20complex%20regulator%2C%20and%20microtubule%20organization%20to%20regulate%20migration.%20These%20findings%20unveil%20a%20critical%20role%20of%20mechanosensation%20in%20neuronal%20migration%2C%20regulating%20the%20rhythmicity%20of%20migration%2C%20in%20concert%20with%20the%20externalization%5C%2Finternalization%20dynamics%20of%20the%20primary%20cilium.%22%2C%22date%22%3A%222025-07-30%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1126%5C%2Fsciadv.adx3846%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22https%3A%5C%2F%5C%2Fwww.science.org%5C%2Fdoi%5C%2F10.1126%5C%2Fsciadv.adx3846%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%22%22%2C%22language%22%3A%22%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-07-31T13%3A45%3A39Z%22%7D%7D%2C%7B%22key%22%3A%22V3P8MHUF%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Huchede%20et%20al.%22%2C%22parsedDate%22%3A%222024-10-07%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BHuchede%2C%20P.%2C%20Meyer%2C%20S.%2C%20Berthelot%2C%20C.%2C%20Hamadou%2C%20M.%2C%20Bertrand-Chapel%2C%20A.%2C%20Rakotomalala%2C%20A.%2C%20Manceau%2C%20L.%2C%20Tomine%2C%20J.%2C%20Lespinasse%2C%20N.%2C%20Lewandowski%2C%20P.%2C%20Cordier-Bussat%2C%20M.%2C%20Broutier%2C%20L.%2C%20Dutour%2C%20A.%2C%20Rochet%2C%20I.%2C%20Blay%2C%20J.-Y.%2C%20Degletagne%2C%20C.%2C%20Attignon%2C%20V.%2C%20Montero-Carcaboso%2C%20A.%2C%20Le%20Grand%2C%20M.%2C%20%26%23×2026%3B%20Castets%2C%20M.%20%282024%29.%20BMP2%20and%20BMP7%20cooperate%20with%20H3.3K27M%20to%20promote%20quiescence%20and%20invasiveness%20in%20pediatric%20diffuse%20midline%20gliomas.%20%26lt%3Bi%26gt%3BeLife%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B12%26lt%3B%5C%2Fi%26gt%3B%2C%20RP91313.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.7554%5C%2FeLife.91313%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.7554%5C%2FeLife.91313%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22BMP2%20and%20BMP7%20cooperate%20with%20H3.3K27M%20to%20promote%20quiescence%20and%20invasiveness%20in%20pediatric%20diffuse%20midline%20gliomas%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Paul%22%2C%22lastName%22%3A%22Huchede%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Swann%22%2C%22lastName%22%3A%22Meyer%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Cl%5Cu00e9ment%22%2C%22lastName%22%3A%22Berthelot%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Maud%22%2C%22lastName%22%3A%22Hamadou%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Adrien%22%2C%22lastName%22%3A%22Bertrand-Chapel%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Andria%22%2C%22lastName%22%3A%22Rakotomalala%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Line%22%2C%22lastName%22%3A%22Manceau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julia%22%2C%22lastName%22%3A%22Tomine%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nicolas%22%2C%22lastName%22%3A%22Lespinasse%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Paul%22%2C%22lastName%22%3A%22Lewandowski%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Martine%22%2C%22lastName%22%3A%22Cordier-Bussat%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Laura%22%2C%22lastName%22%3A%22Broutier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Aur%5Cu00e9lie%22%2C%22lastName%22%3A%22Dutour%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Isabelle%22%2C%22lastName%22%3A%22Rochet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jean-Yves%22%2C%22lastName%22%3A%22Blay%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Cyril%22%2C%22lastName%22%3A%22Degletagne%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Val%5Cu00e9ry%22%2C%22lastName%22%3A%22Attignon%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Angel%22%2C%22lastName%22%3A%22Montero-Carcaboso%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Marion%22%2C%22lastName%22%3A%22Le%20Grand%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Eddy%22%2C%22lastName%22%3A%22Pasquier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alexandre%22%2C%22lastName%22%3A%22Vasiljevic%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pascale%22%2C%22lastName%22%3A%22Gilardi-Hebenstreit%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Samuel%22%2C%22lastName%22%3A%22Meignan%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pierre%22%2C%22lastName%22%3A%22Leblond%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Erika%22%2C%22lastName%22%3A%22Cosset%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Marie%22%2C%22lastName%22%3A%22Castets%22%7D%5D%2C%22abstractNote%22%3A%22Pediatric%20diffuse%20midline%20gliomas%20%28pDMG%29%20are%20an%20aggressive%20type%20of%20childhood%20cancer%20with%20a%20fatal%20outcome.%20Their%20major%20epigenetic%20determinism%20has%20become%20clear%2C%20notably%20with%20the%20identification%20of%20K27M%20mutations%20in%20histone%20H3.%20However%2C%20the%20synergistic%20oncogenic%20mechanisms%20that%20induce%20and%20maintain%20tumor%20cell%20phenotype%20have%20yet%20to%20be%20deciphered.%20In%2020%20to%2030%25%20of%20cases%2C%20these%20tumors%20have%20an%20altered%20BMP%20signaling%20pathway%20with%20an%20oncogenic%20mutation%20on%20the%20BMP%20type%20I%20receptor%20ALK2%2C%20encoded%20by%20ACVR1.%20However%2C%20the%20potential%20impact%20of%20the%20BMP%20pathway%20in%20tumors%20non-mutated%20for%20ACVR1%20is%20less%20clear.%20By%20integrating%20bulk%2C%20single-cell%2C%20and%20spatial%20transcriptomic%20data%2C%20we%20show%20here%20that%20the%20BMP%20signaling%20pathway%20is%20activated%20at%20similar%20levels%20between%20ACVR1%20wild-type%20and%20mutant%20tumors%20and%20identify%20BMP2%20and%20BMP7%20as%20putative%20activators%20of%20the%20pathway%20in%20a%20specific%20subpopulation%20of%20cells.%20By%20using%20both%20pediatric%20isogenic%20glioma%20lines%20genetically%20modified%20to%20overexpress%20H3.3K27M%20and%20patients-derived%20DIPG%20cell%20lines%2C%20we%20demonstrate%20that%20BMP2%5C%2F7%20synergizes%20with%20H3.3K27M%20to%20induce%20a%20transcriptomic%20rewiring%20associated%20with%20a%20quiescent%20but%20invasive%20cell%20state.%20These%20data%20suggest%20a%20generic%20oncogenic%20role%20for%20the%20BMP%20pathway%20in%20gliomagenesis%20of%20pDMG%20and%20pave%20the%20way%20for%20specific%20targeting%20of%20downstream%20effectors%20mediating%20the%20K27M%5C%2FBMP%20crosstalk.%22%2C%22date%22%3A%222024-10-07%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.7554%5C%2FeLife.91313%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%222050-084X%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22274JEH8E%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Rodr%5Cu00edguez-Mart%5Cu00edn%20et%20al.%22%2C%22parsedDate%22%3A%222024-04-10%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BRodr%26%23xED%3Bguez-Mart%26%23xED%3Bn%2C%20M.%2C%20B%26%23xE1%3Bez-Flores%2C%20J.%2C%20Ribes%2C%20V.%2C%20Isidoro-Garc%26%23xED%3Ba%2C%20M.%2C%20Lacal%2C%20J.%2C%20%26amp%3B%20Prieto-Matos%2C%20P.%20%282024%29.%20Non-Mammalian%20Models%20for%20Understanding%20Neurological%20Defects%20in%20RASopathies.%20%26lt%3Bi%26gt%3BBiomedicines%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B12%26lt%3B%5C%2Fi%26gt%3B%284%29%2C%20841.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.3390%5C%2Fbiomedicines12040841%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.3390%5C%2Fbiomedicines12040841%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Non-Mammalian%20Models%20for%20Understanding%20Neurological%20Defects%20in%20RASopathies%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mario%22%2C%22lastName%22%3A%22Rodr%5Cu00edguez-Mart%5Cu00edn%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Juan%22%2C%22lastName%22%3A%22B%5Cu00e1ez-Flores%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mar%5Cu00eda%22%2C%22lastName%22%3A%22Isidoro-Garc%5Cu00eda%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jesus%22%2C%22lastName%22%3A%22Lacal%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pablo%22%2C%22lastName%22%3A%22Prieto-Matos%22%7D%5D%2C%22abstractNote%22%3A%22RASopathies%2C%20a%20group%20of%20neurodevelopmental%20congenital%20disorders%20stemming%20from%20mutations%20in%20the%20RAS%5C%2FMAPK%20pathway%2C%20present%20a%20unique%20opportunity%20to%20delve%20into%20the%20intricacies%20of%20complex%20neurological%20disorders.%20Afflicting%20approximately%20one%20in%20a%20thousand%20newborns%2C%20RASopathies%20manifest%20as%20abnormalities%20across%20multiple%20organ%20systems%2C%20with%20a%20pronounced%20impact%20on%20the%20central%20and%20peripheral%20nervous%20system.%20In%20the%20pursuit%20of%20understanding%20RASopathies%26%23039%3B%20neurobiology%20and%20establishing%20phenotype-genotype%20relationships%2C%20in%20vivo%20non-mammalian%20models%20have%20emerged%20as%20indispensable%20tools.%20Species%20such%20as%20Danio%20rerio%2C%20Drosophila%20melanogaster%2C%20Caenorhabditis%20elegans%2C%20Xenopus%20species%20and%20Gallus%20gallus%20embryos%20have%20proven%20to%20be%20invaluable%20in%20shedding%20light%20on%20the%20intricate%20pathways%20implicated%20in%20RASopathies.%20Despite%20some%20inherent%20weaknesses%2C%20these%20genetic%20models%20offer%20distinct%20advantages%20over%20traditional%20rodent%20models%2C%20providing%20a%20holistic%20perspective%20on%20complex%20genetics%2C%20multi-organ%20involvement%2C%20and%20the%20interplay%20among%20various%20pathway%20components%2C%20offering%20insights%20into%20the%20pathophysiological%20aspects%20of%20mutations-driven%20symptoms.%20This%20review%20underscores%20the%20value%20of%20investigating%20the%20genetic%20basis%20of%20RASopathies%20for%20unraveling%20the%20underlying%20mechanisms%20contributing%20to%20broader%20neurological%20complexities.%20It%20also%20emphasizes%20the%20pivotal%20role%20of%20non-mammalian%20models%20in%20serving%20as%20a%20crucial%20preliminary%20step%20for%20the%20development%20of%20innovative%20therapeutic%20strategies.%22%2C%22date%22%3A%222024-04-10%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.3390%5C%2Fbiomedicines12040841%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%222227-9059%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22SNLMHYWE%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Mirdass%20et%20al.%22%2C%22parsedDate%22%3A%222023-12-18%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BMirdass%2C%20C.%2C%20Catala%2C%20M.%2C%20Bocel%2C%20M.%2C%20Nedelec%2C%20S.%2C%20%26amp%3B%20Ribes%2C%20V.%20%282023%29.%20Stem%20cell-derived%20models%20of%20spinal%20neurulation.%20%26lt%3Bi%26gt%3BEmerging%20Topics%20in%20Life%20Sciences%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B7%26lt%3B%5C%2Fi%26gt%3B%284%29%2C%20423%26%23×2013%3B437.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1042%5C%2FETLS20230087%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1042%5C%2FETLS20230087%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Stem%20cell-derived%20models%20of%20spinal%20neurulation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Camil%22%2C%22lastName%22%3A%22Mirdass%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Martin%22%2C%22lastName%22%3A%22Catala%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mika%5Cu00eblle%22%2C%22lastName%22%3A%22Bocel%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%5D%2C%22abstractNote%22%3A%22Neurulation%20is%20a%20critical%20step%20in%20early%20embryonic%20development%2C%20giving%20rise%20to%20the%20neural%20tube%2C%20the%20primordium%20of%20the%20central%20nervous%20system%20in%20amniotes.%20Understanding%20this%20complex%2C%20multi-scale%2C%20multi-tissue%20morphogenetic%20process%20is%20essential%20to%20provide%20insights%20into%20normal%20development%20and%20the%20etiology%20of%20neural%20tube%20defects.%20Innovations%20in%20tissue%20engineering%20have%20fostered%20the%20generation%20of%20pluripotent%20stem%20cell-based%20in%20vitro%20models%2C%20including%20organoids%2C%20that%20are%20emerging%20as%20unique%20tools%20for%20delving%20into%20neurulation%20mechanisms%2C%20especially%20in%20the%20context%20of%20human%20development.%20Each%20model%20captures%20specific%20aspects%20of%20neural%20tube%20morphogenesis%2C%20from%20epithelialization%20to%20neural%20tissue%20elongation%2C%20folding%20and%20cavitation.%20In%20particular%2C%20the%20recent%20models%20of%20human%20and%20mouse%20trunk%20morphogenesis%2C%20such%20as%20gastruloids%2C%20that%20form%20a%20spinal%20neural%20plate-like%20or%20neural%20tube-like%20structure%20are%20opening%20new%20avenues%20to%20study%20normal%20and%20pathological%20neurulation.%20Here%2C%20we%20review%20the%20morphogenetic%20events%20generating%20the%20neural%20tube%20in%20the%20mammalian%20embryo%20and%20questions%20that%20remain%20unanswered.%20We%20discuss%20the%20advantages%20and%20limitations%20of%20existing%20in%20vitro%20models%20of%20neurulation%20and%20possible%20future%20technical%20developments.%22%2C%22date%22%3A%222023-12-18%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1042%5C%2FETLS20230087%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%222397-8554%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22PAS5QN45%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Gribaudo%20et%20al.%22%2C%22parsedDate%22%3A%222023-09-14%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BGribaudo%2C%20S.%2C%20Robert%2C%20R.%2C%20van%20Sambeek%2C%20B.%2C%20Mirdass%2C%20C.%2C%20Lyubimova%2C%20A.%2C%20Bouhali%2C%20K.%2C%20Ferent%2C%20J.%2C%20Morin%2C%20X.%2C%20van%20Oudenaarden%2C%20A.%2C%20%26amp%3B%20Nedelec%2C%20S.%20%282023%29.%20Self-organizing%20models%20of%20human%20trunk%20organogenesis%20recapitulate%20spinal%20cord%20and%20spine%20co-morphogenesis.%20%26lt%3Bi%26gt%3BNature%20Biotechnology%26lt%3B%5C%2Fi%26gt%3B.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41587-023-01956-9%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41587-023-01956-9%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Self-organizing%20models%20of%20human%20trunk%20organogenesis%20recapitulate%20spinal%20cord%20and%20spine%20co-morphogenesis%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Simona%22%2C%22lastName%22%3A%22Gribaudo%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22R%5Cu00e9mi%22%2C%22lastName%22%3A%22Robert%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Bj%5Cu00f6rn%22%2C%22lastName%22%3A%22van%20Sambeek%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Camil%22%2C%22lastName%22%3A%22Mirdass%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Anna%22%2C%22lastName%22%3A%22Lyubimova%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Kamal%22%2C%22lastName%22%3A%22Bouhali%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julien%22%2C%22lastName%22%3A%22Ferent%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Xavier%22%2C%22lastName%22%3A%22Morin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alexander%22%2C%22lastName%22%3A%22van%20Oudenaarden%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%5D%2C%22abstractNote%22%3A%22Integrated%20in%20vitro%20models%20of%20human%20organogenesis%20are%20needed%20to%20elucidate%20the%20multi-systemic%20events%20underlying%20development%20and%20disease.%20Here%20we%20report%20the%20generation%20of%20human%20trunk-like%20structures%20that%20model%20the%20co-morphogenesis%2C%20patterning%20and%20differentiation%20of%20the%20human%20spine%20and%20spinal%20cord.%20We%20identified%20differentiation%20conditions%20for%20human%20pluripotent%20stem%20cells%20favoring%20the%20formation%20of%20an%20embryo-like%20extending%20antero-posterior%20%28AP%29%20axis.%20Single-cell%20and%20spatial%20transcriptomics%20show%20that%20somitic%20and%20spinal%20cord%20differentiation%20trajectories%20organize%20along%20this%20axis%20and%20can%20self-assemble%20into%20a%20neural%20tube%20surrounded%20by%20somites%20upon%20extracellular%20matrix%20addition.%20Morphogenesis%20is%20coupled%20with%20AP%20patterning%20mechanisms%2C%20which%20results%2C%20at%20later%20stages%20of%20organogenesis%2C%20in%20in%20vivo-like%20arrays%20of%20neural%20subtypes%20along%20a%20neural%20tube%20surrounded%20by%20spine%20and%20muscle%20progenitors%20contacted%20by%20neuronal%20projections.%20This%20integrated%20system%20of%20trunk%20development%20indicates%20that%20in%20vivo-like%20multi-tissue%20co-morphogenesis%20and%20topographic%20organization%20of%20terminal%20cell%20types%20can%20be%20achieved%20in%20human%20organoids%2C%20opening%20windows%20for%20the%20development%20of%20more%20complex%20models%20of%20organogenesis.%22%2C%22date%22%3A%222023-09-14%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41587-023-01956-9%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221546-1696%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22RZ5P3XKY%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Liau%20et%20al.%22%2C%22parsedDate%22%3A%222023-01-03%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BLiau%2C%20E.%20S.%2C%20Jin%2C%20S.%2C%20Chen%2C%20Y.-C.%2C%20Liu%2C%20W.-S.%2C%20Calon%2C%20M.%2C%20Nedelec%2C%20S.%2C%20Nie%2C%20Q.%2C%20%26amp%3B%20Chen%2C%20J.-A.%20%282023%29.%20Single-cell%20transcriptomic%20analysis%20reveals%20diversity%20within%20mammalian%20spinal%20motor%20neurons.%20%26lt%3Bi%26gt%3BNature%20Communications%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B14%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%2046.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41467-022-35574-x%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41467-022-35574-x%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Single-cell%20transcriptomic%20analysis%20reveals%20diversity%20within%20mammalian%20spinal%20motor%20neurons%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ee%20Shan%22%2C%22lastName%22%3A%22Liau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Suoqin%22%2C%22lastName%22%3A%22Jin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Yen-Chung%22%2C%22lastName%22%3A%22Chen%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Wei-Szu%22%2C%22lastName%22%3A%22Liu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ma%5Cu00ebliss%22%2C%22lastName%22%3A%22Calon%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Qing%22%2C%22lastName%22%3A%22Nie%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jun-An%22%2C%22lastName%22%3A%22Chen%22%7D%5D%2C%22abstractNote%22%3A%22Spinal%20motor%20neurons%20%28MNs%29%20integrate%20sensory%20stimuli%20and%20brain%20commands%20to%20generate%20movements.%20In%20vertebrates%2C%20the%20molecular%20identities%20of%20the%20cardinal%20MN%20types%20such%20as%20those%20innervating%20limb%20versus%20trunk%20muscles%20are%20well%20elucidated.%20Yet%20the%20identities%20of%20finer%20subtypes%20within%20these%20cell%20populations%20that%20innervate%20individual%20muscle%20groups%20remain%20enigmatic.%20Here%20we%20investigate%20heterogeneity%20in%20mouse%20MNs%20using%20single-cell%20transcriptomics.%20Among%20limb-innervating%20MNs%2C%20we%20reveal%20a%20diverse%20neuropeptide%20code%20for%20delineating%20putative%20motor%20pool%20identities.%20Additionally%2C%20we%20uncover%20that%20axial%20MNs%20are%20subdivided%20into%20three%20molecularly%20distinct%20subtypes%2C%20defined%20by%20mediolaterally-biased%20Satb2%2C%20Nr2f2%20or%20Bcl11b%20expression%20patterns%20with%20different%20axon%20guidance%20signatures.%20These%20three%20subtypes%20are%20present%20in%20chicken%20and%20human%20embryos%2C%20suggesting%20a%20conserved%20axial%20MN%20expression%20pattern%20across%20higher%20vertebrates.%20Overall%2C%20our%20study%20provides%20a%20molecular%20resource%20of%20spinal%20MN%20types%20and%20paves%20the%20way%20towards%20deciphering%20how%20neuronal%20subtypes%20evolved%20to%20accommodate%20vertebrate%20motor%20behaviors.%22%2C%22date%22%3A%222023-01-03%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41467-022-35574-x%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%222041-1723%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22XKLFGQ38%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Manceau%20et%20al.%22%2C%22parsedDate%22%3A%222022-05%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BManceau%2C%20L.%2C%20Richard%20Albert%2C%20J.%2C%20Lollini%2C%20P.-L.%2C%20Greenberg%2C%20M.%20V.%20C.%2C%20Gilardi-Hebenstreit%2C%20P.%2C%20%26amp%3B%20Ribes%2C%20V.%20%282022%29.%20Divergent%20transcriptional%20and%20transforming%20properties%20of%20PAX3-FOXO1%20and%20PAX7-FOXO1%20paralogs.%20%26lt%3Bi%26gt%3BPLoS%20Genetics%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B18%26lt%3B%5C%2Fi%26gt%3B%285%29%2C%20e1009782.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1371%5C%2Fjournal.pgen.1009782%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1371%5C%2Fjournal.pgen.1009782%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Divergent%20transcriptional%20and%20transforming%20properties%20of%20PAX3-FOXO1%20and%20PAX7-FOXO1%20paralogs%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Line%22%2C%22lastName%22%3A%22Manceau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julien%22%2C%22lastName%22%3A%22Richard%20Albert%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pier-Luigi%22%2C%22lastName%22%3A%22Lollini%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Maxim%20V.%20C.%22%2C%22lastName%22%3A%22Greenberg%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pascale%22%2C%22lastName%22%3A%22Gilardi-Hebenstreit%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%5D%2C%22abstractNote%22%3A%22The%20hallmarks%20of%20the%20alveolar%20subclass%20of%20rhabdomyosarcoma%20are%20chromosomal%20translocations%20that%20generate%20chimeric%20PAX3-FOXO1%20or%20PAX7-FOXO1%20transcription%20factors.%20Overexpression%20of%20either%20PAX-FOXO1s%20results%20in%20related%20cell%20transformation%20in%20animal%20models.%20Yet%2C%20in%20patients%20the%20two%20structural%20genetic%20aberrations%20they%20derived%20from%20are%20associated%20with%20distinct%20pathological%20manifestations.%20To%20assess%20the%20mechanisms%20underlying%20these%20differences%2C%20we%20generated%20isogenic%20fibroblast%20lines%20expressing%20either%20PAX-FOXO1%20paralog.%20Mapping%20of%20their%20genomic%20recruitment%20using%20CUT%26amp%3BTag%20revealed%20that%20the%20two%20chimeric%20proteins%20have%20distinct%20DNA%20binding%20preferences.%20In%20addition%2C%20PAX7-FOXO1%20binding%20results%20in%20greater%20recruitment%20of%20the%20H3K27ac%20activation%20mark%20than%20PAX3-FOXO1%20binding%20and%20is%20accompanied%20by%20greater%20transcriptional%20activation%20of%20neighbouring%20genes.%20These%20effects%20are%20associated%20with%20a%20PAX-FOXO1-specific%20alteration%20in%20the%20expression%20of%20genes%20regulating%20cell%20shape%20and%20the%20cell%20cycle.%20Consistently%2C%20PAX3-FOXO1%20accentuates%20fibroblast%20cellular%20traits%20associated%20with%20contractility%20and%20surface%20adhesion%20and%20limits%20entry%20into%20S%20phase.%20In%20contrast%2C%20PAX7-FOXO1%20drives%20cells%20to%20adopt%20an%20amoeboid%20shape%2C%20reduces%20entry%20into%20M%20phase%2C%20and%20causes%20increased%20DNA%20damage.%20Altogether%2C%20our%20results%20argue%20that%20the%20diversity%20of%20rhabdomyosarcoma%20manifestation%20arises%2C%20in%20part%2C%20from%20the%20divergence%20between%20the%20genomic%20occupancy%20and%20transcriptional%20activity%20of%20PAX3-FOXO1%20and%20PAX7-FOXO1.%22%2C%22date%22%3A%222022-05%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1371%5C%2Fjournal.pgen.1009782%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221553-7404%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%229HV5ZNAP%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Mouilleau%20et%20al.%22%2C%22parsedDate%22%3A%222021-03-29%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BMouilleau%2C%20V.%2C%20Vaslin%2C%20C.%2C%20Robert%2C%20R.%2C%20Gribaudo%2C%20S.%2C%20Nicolas%2C%20N.%2C%20Jarrige%2C%20M.%2C%20Terray%2C%20A.%2C%20Lesueur%2C%20L.%2C%20Mathis%2C%20M.%20W.%2C%20Croft%2C%20G.%2C%20Daynac%2C%20M.%2C%20Rouiller-Fabre%2C%20V.%2C%20Wichterle%2C%20H.%2C%20Ribes%2C%20V.%2C%20Martinat%2C%20C.%2C%20%26amp%3B%20Nedelec%2C%20S.%20%282021%29.%20Dynamic%20extrinsic%20pacing%20of%20the%20HOX%20clock%20in%20human%20axial%20progenitors%20controls%20motor%20neuron%20subtype%20specification.%20%26lt%3Bi%26gt%3BDevelopment%20%28Cambridge%2C%20England%29%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B148%26lt%3B%5C%2Fi%26gt%3B%286%29%2C%20dev194514.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fdev.194514%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fdev.194514%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Dynamic%20extrinsic%20pacing%20of%20the%20HOX%20clock%20in%20human%20axial%20progenitors%20controls%20motor%20neuron%20subtype%20specification%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vincent%22%2C%22lastName%22%3A%22Mouilleau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%5Cu00e9lia%22%2C%22lastName%22%3A%22Vaslin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22R%5Cu00e9mi%22%2C%22lastName%22%3A%22Robert%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Simona%22%2C%22lastName%22%3A%22Gribaudo%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nour%22%2C%22lastName%22%3A%22Nicolas%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Margot%22%2C%22lastName%22%3A%22Jarrige%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ang%5Cu00e9lique%22%2C%22lastName%22%3A%22Terray%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22L%5Cu00e9a%22%2C%22lastName%22%3A%22Lesueur%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mackenzie%20W.%22%2C%22lastName%22%3A%22Mathis%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gist%22%2C%22lastName%22%3A%22Croft%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mathieu%22%2C%22lastName%22%3A%22Daynac%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Virginie%22%2C%22lastName%22%3A%22Rouiller-Fabre%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Hynek%22%2C%22lastName%22%3A%22Wichterle%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%5Cu00e9cile%22%2C%22lastName%22%3A%22Martinat%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%5D%2C%22abstractNote%22%3A%22Rostro-caudal%20patterning%20of%20vertebrates%20depends%20on%20the%20temporally%20progressive%20activation%20of%20HOX%20genes%20within%20axial%20stem%20cells%20that%20fuel%20axial%20embryo%20elongation.%20Whether%20the%20pace%20of%20sequential%20activation%20of%20HOX%20genes%2C%20the%20%26%23039%3BHOX%20clock%26%23039%3B%2C%20is%20controlled%20by%20intrinsic%20chromatin-based%20timing%20mechanisms%20or%20by%20temporal%20changes%20in%20extrinsic%20cues%20remains%20unclear.%20Here%2C%20we%20studied%20HOX%20clock%20pacing%20in%20human%20pluripotent%20stem%20cell-derived%20axial%20progenitors%20differentiating%20into%20diverse%20spinal%20cord%20motor%20neuron%20subtypes.%20We%20show%20that%20the%20progressive%20activation%20of%20caudal%20HOX%20genes%20is%20controlled%20by%20a%20dynamic%20increase%20in%20FGF%20signaling.%20Blocking%20the%20FGF%20pathway%20stalled%20induction%20of%20HOX%20genes%2C%20while%20a%20precocious%20increase%20of%20FGF%2C%20alone%20or%20with%20GDF11%20ligand%2C%20accelerated%20the%20HOX%20clock.%20Cells%20differentiated%20under%20accelerated%20HOX%20induction%20generated%20appropriate%20posterior%20motor%20neuron%20subtypes%20found%20along%20the%20human%20embryonic%20spinal%20cord.%20The%20pacing%20of%20the%20HOX%20clock%20is%20thus%20dynamically%20regulated%20by%20exposure%20to%20secreted%20cues.%20Its%20manipulation%20by%20extrinsic%20factors%20provides%20synchronized%20access%20to%20multiple%20human%20neuronal%20subtypes%20of%20distinct%20rostro-caudal%20identities%20for%20basic%20and%20translational%20applications.This%20article%20has%20an%20associated%20%26%23039%3BThe%20people%20behind%20the%20papers%26%23039%3B%20interview.%22%2C%22date%22%3A%222021-03-29%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1242%5C%2Fdev.194514%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221477-9129%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22A7IZNFXP%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Nedelec%20and%20Martinez-Arias%22%2C%22parsedDate%22%3A%222021-02%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BNedelec%2C%20S.%2C%20%26amp%3B%20Martinez-Arias%2C%20A.%20%282021%29.%20In%20vitro%20models%20of%20spinal%20motor%20circuit%26%23×2019%3Bs%20development%20in%20mammals%3A%20achievements%20and%20challenges.%20%26lt%3Bi%26gt%3BCurrent%20Opinion%20in%20Neurobiology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B66%26lt%3B%5C%2Fi%26gt%3B%2C%20240%26%23×2013%3B249.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.conb.2020.12.002%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.conb.2020.12.002%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22In%20vitro%20models%20of%20spinal%20motor%20circuit%27s%20development%20in%20mammals%3A%20achievements%20and%20challenges%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alfonso%22%2C%22lastName%22%3A%22Martinez-Arias%22%7D%5D%2C%22abstractNote%22%3A%22The%20connectivity%20patterns%20of%20neurons%20sustaining%20the%20functionality%20of%20spinal%20locomotor%20circuits%20rely%20on%20the%20specification%20of%20hundreds%20of%20motor%20neuron%20and%20interneuron%20subtypes%20precisely%20arrayed%20within%20the%20embryonic%20spinal%20cord.%20Knowledge%20acquired%20by%20developmental%20biologists%20on%20the%20molecular%20mechanisms%20underpinning%20this%20process%20in%20vivo%20has%20supported%20the%20development%20of%202D%20and%203D%20differentiation%20strategies%20to%20generate%20spinal%20neuronal%20diversity%20from%20mouse%20and%20human%20pluripotent%20stem%20cells%20%28PSCs%29.%20Here%2C%20we%20review%20recent%20breakthroughs%20in%20this%20field%20and%20the%20perspectives%20opened%20up%20by%20models%20of%20in%20vitro%20embryogenesis%20to%20approach%20the%20mechanisms%20underlying%20neuronal%20diversification%20and%20the%20formation%20of%20functional%20mouse%20and%20human%20locomotor%20circuits.%20Beyond%20serving%20fundamental%20investigations%2C%20these%20new%20approaches%20should%20help%20engineering%20neuronal%20circuits%20differentially%20impacted%20in%20neuromuscular%20disorders%2C%20such%20as%20amyotrophic%20lateral%20sclerosis%20or%20spinal%20muscular%20atrophies%2C%20and%20thus%20open%20new%20avenues%20for%20disease%20modeling%20and%20drug%20screenings.%22%2C%22date%22%3A%222021-02%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.conb.2020.12.002%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221873-6882%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22URU7A59T%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Gonzalez%20Curto%20et%20al.%22%2C%22parsedDate%22%3A%222020-11%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BGonzalez%20Curto%2C%20G.%2C%20Der%20Vartanian%2C%20A.%2C%20Frarma%2C%20Y.%20E.-M.%2C%20Manceau%2C%20L.%2C%20Baldi%2C%20L.%2C%20Prisco%2C%20S.%2C%20Elarouci%2C%20N.%2C%20Causeret%2C%20F.%2C%20Korenkov%2C%20D.%2C%20Rigolet%2C%20M.%2C%20Aurade%2C%20F.%2C%20De%20Reynies%2C%20A.%2C%20Contremoulins%2C%20V.%2C%20Relaix%2C%20F.%2C%20Faklaris%2C%20O.%2C%20Briscoe%2C%20J.%2C%20Gilardi-Hebenstreit%2C%20P.%2C%20%26amp%3B%20Ribes%2C%20V.%20%282020%29.%20The%20PAX-FOXO1s%20trigger%20fast%20trans-differentiation%20of%20chick%20embryonic%20neural%20cells%20into%20alveolar%20rhabdomyosarcoma%20with%20tissue%20invasive%20properties%20limited%20by%20S%20phase%20entry%20inhibition.%20%26lt%3Bi%26gt%3BPLoS%20Genetics%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B16%26lt%3B%5C%2Fi%26gt%3B%2811%29%2C%20e1009164.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1371%5C%2Fjournal.pgen.1009164%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1371%5C%2Fjournal.pgen.1009164%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22The%20PAX-FOXO1s%20trigger%20fast%20trans-differentiation%20of%20chick%20embryonic%20neural%20cells%20into%20alveolar%20rhabdomyosarcoma%20with%20tissue%20invasive%20properties%20limited%20by%20S%20phase%20entry%20inhibition%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gloria%22%2C%22lastName%22%3A%22Gonzalez%20Curto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Audrey%22%2C%22lastName%22%3A%22Der%20Vartanian%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Youcef%20El-Mokhtar%22%2C%22lastName%22%3A%22Frarma%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Line%22%2C%22lastName%22%3A%22Manceau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lorenzo%22%2C%22lastName%22%3A%22Baldi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Selene%22%2C%22lastName%22%3A%22Prisco%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nabila%22%2C%22lastName%22%3A%22Elarouci%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Causeret%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Daniil%22%2C%22lastName%22%3A%22Korenkov%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Muriel%22%2C%22lastName%22%3A%22Rigolet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Aurade%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Aur%5Cu00e9lien%22%2C%22lastName%22%3A%22De%20Reynies%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vincent%22%2C%22lastName%22%3A%22Contremoulins%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Relaix%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Orestis%22%2C%22lastName%22%3A%22Faklaris%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22James%22%2C%22lastName%22%3A%22Briscoe%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pascale%22%2C%22lastName%22%3A%22Gilardi-Hebenstreit%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%5D%2C%22abstractNote%22%3A%22The%20chromosome%20translocations%20generating%20PAX3-FOXO1%20and%20PAX7-FOXO1%20chimeric%20proteins%20are%20the%20primary%20hallmarks%20of%20the%20paediatric%20fusion-positive%20alveolar%20subtype%20of%20Rhabdomyosarcoma%20%28FP-RMS%29.%20Despite%20the%20ability%20of%20these%20transcription%20factors%20to%20remodel%20chromatin%20landscapes%20and%20promote%20the%20expression%20of%20tumour%20driver%20genes%2C%20they%20only%20inefficiently%20promote%20malignant%20transformation%20in%20vivo.%20The%20reason%20for%20this%20is%20unclear.%20To%20address%20this%2C%20we%20developed%20an%20in%20ovo%20model%20to%20follow%20the%20response%20of%20spinal%20cord%20progenitors%20to%20PAX-FOXO1s.%20Our%20data%20demonstrate%20that%20PAX-FOXO1s%2C%20but%20not%20wild-type%20PAX3%20or%20PAX7%2C%20trigger%20the%20trans-differentiation%20of%20neural%20cells%20into%20FP-RMS-like%20cells%20with%20myogenic%20characteristics.%20In%20parallel%2C%20PAX-FOXO1s%20remodel%20the%20neural%20pseudo-stratified%20epithelium%20into%20a%20cohesive%20mesenchyme%20capable%20of%20tissue%20invasion.%20Surprisingly%2C%20expression%20of%20PAX-FOXO1s%2C%20similar%20to%20wild-type%20PAX3%5C%2F7%2C%20reduce%20the%20levels%20of%20CDK-CYCLIN%20activity%20and%20increase%20the%20fraction%20of%20cells%20in%20G1.%20Introduction%20of%20CYCLIN%20D1%20or%20MYCN%20overcomes%20this%20PAX-FOXO1-mediated%20cell%20cycle%20inhibition%20and%20promotes%20tumour%20growth.%20Together%2C%20our%20findings%20reveal%20a%20mechanism%20that%20can%20explain%20the%20apparent%20limited%20oncogenicity%20of%20PAX-FOXO1%20fusion%20transcription%20factors.%20They%20are%20also%20consistent%20with%20certain%20clinical%20reports%20indicative%20of%20a%20neural%20origin%20of%20FP-RMS.%22%2C%22date%22%3A%222020-11%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1371%5C%2Fjournal.pgen.1009164%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221553-7404%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%222VKRM6UL%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Kumamoto%20et%20al.%22%2C%22parsedDate%22%3A%222020-08-19%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BKumamoto%2C%20T.%2C%20Maurinot%2C%20F.%2C%20Barry-Martinet%2C%20R.%2C%20Vaslin%2C%20C.%2C%20Vandormael-Pournin%2C%20S.%2C%20Le%2C%20M.%2C%20Lerat%2C%20M.%2C%20Niculescu%2C%20D.%2C%20Cohen-Tannoudji%2C%20M.%2C%20Rebsam%2C%20A.%2C%20Loulier%2C%20K.%2C%20Nedelec%2C%20S.%2C%20Tozer%2C%20S.%2C%20%26amp%3B%20Livet%2C%20J.%20%282020%29.%20Direct%20Readout%20of%20Neural%20Stem%20Cell%20Transgenesis%20with%20an%20Integration-Coupled%20Gene%20Expression%20Switch.%20%26lt%3Bi%26gt%3BNeuron%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B107%26lt%3B%5C%2Fi%26gt%3B%284%29%2C%20617-630.e6.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.neuron.2020.05.038%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.neuron.2020.05.038%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Direct%20Readout%20of%20Neural%20Stem%20Cell%20Transgenesis%20with%20an%20Integration-Coupled%20Gene%20Expression%20Switch%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Takuma%22%2C%22lastName%22%3A%22Kumamoto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Franck%22%2C%22lastName%22%3A%22Maurinot%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Rapha%5Cu00eblle%22%2C%22lastName%22%3A%22Barry-Martinet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%5Cu00e9lia%22%2C%22lastName%22%3A%22Vaslin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Sandrine%22%2C%22lastName%22%3A%22Vandormael-Pournin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Micka%5Cu00ebl%22%2C%22lastName%22%3A%22Le%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Marion%22%2C%22lastName%22%3A%22Lerat%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Dragos%22%2C%22lastName%22%3A%22Niculescu%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Michel%22%2C%22lastName%22%3A%22Cohen-Tannoudji%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alexandra%22%2C%22lastName%22%3A%22Rebsam%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Karine%22%2C%22lastName%22%3A%22Loulier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Samuel%22%2C%22lastName%22%3A%22Tozer%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jean%22%2C%22lastName%22%3A%22Livet%22%7D%5D%2C%22abstractNote%22%3A%22Stable%20genomic%20integration%20of%20exogenous%20transgenes%20is%20essential%20in%20neurodevelopmental%20and%20stem%20cell%20studies.%20Despite%20tools%20driving%20increasingly%20efficient%20genomic%20insertion%20with%20DNA%20vectors%2C%20transgenesis%20remains%20fundamentally%20hindered%20by%20the%20impossibility%20of%20distinguishing%20integrated%20from%20episomal%20transgenes.%20Here%2C%20we%20introduce%20an%20integration-coupled%20On%20genetic%20switch%2C%20iOn%2C%20which%20triggers%20gene%20expression%20upon%20incorporation%20into%20the%20host%20genome%20through%20transposition%2C%20thus%20enabling%20rapid%20and%20accurate%20identification%20of%20integration%20events%20following%20transfection%20with%20naked%20plasmids.%20In%5Cu00a0vitro%2C%20iOn%20permits%20rapid%20drug-free%20stable%20transgenesis%20of%20mouse%20and%20human%20pluripotent%20stem%20cells%20with%20multiple%20vectors.%20In%5Cu00a0vivo%2C%20we%20demonstrate%20faithful%20cell%20lineage%20tracing%2C%20assessment%20of%20regulatory%20elements%2C%20and%20mosaic%20analysis%20of%20gene%20function%20in%20somatic%20transgenesis%20experiments%20that%20reveal%20neural%20progenitor%20potentialities%20and%20interaction.%20These%20results%20establish%20iOn%20as%20a%20universally%20applicable%20strategy%20to%20accelerate%20and%20simplify%20genetic%20engineering%20in%20cultured%20systems%20and%20model%20organisms%20by%20conditioning%20transgene%20activation%20to%20genomic%20integration.%22%2C%22date%22%3A%222020-08-19%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.neuron.2020.05.038%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221097-4199%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22KQR7QR5U%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Darrigrand%20et%20al.%22%2C%22parsedDate%22%3A%222020-02-27%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BDarrigrand%2C%20J.-F.%2C%20Valente%2C%20M.%2C%20Comai%2C%20G.%2C%20Martinez%2C%20P.%2C%20Petit%2C%20M.%2C%20Nishinakamura%2C%20R.%2C%20Osorio%2C%20D.%20S.%2C%20Renault%2C%20G.%2C%20Marchiol%2C%20C.%2C%20Ribes%2C%20V.%2C%20%26amp%3B%20Cadot%2C%20B.%20%282020%29.%20Dullard-mediated%20Smad1%5C%2F5%5C%2F8%20inhibition%20controls%20mouse%20cardiac%20neural%20crest%20cells%20condensation%20and%20outflow%20tract%20septation.%20%26lt%3Bi%26gt%3BeLife%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B9%26lt%3B%5C%2Fi%26gt%3B%2C%20e50325.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.7554%5C%2FeLife.50325%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.7554%5C%2FeLife.50325%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Dullard-mediated%20Smad1%5C%2F5%5C%2F8%20inhibition%20controls%20mouse%20cardiac%20neural%20crest%20cells%20condensation%20and%20outflow%20tract%20septation%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Jean-Fran%5Cu00e7ois%22%2C%22lastName%22%3A%22Darrigrand%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mariana%22%2C%22lastName%22%3A%22Valente%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Glenda%22%2C%22lastName%22%3A%22Comai%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pauline%22%2C%22lastName%22%3A%22Martinez%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Maxime%22%2C%22lastName%22%3A%22Petit%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ryuichi%22%2C%22lastName%22%3A%22Nishinakamura%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Daniel%20S.%22%2C%22lastName%22%3A%22Osorio%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gilles%22%2C%22lastName%22%3A%22Renault%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Carmen%22%2C%22lastName%22%3A%22Marchiol%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Bruno%22%2C%22lastName%22%3A%22Cadot%22%7D%5D%2C%22abstractNote%22%3A%22The%20establishment%20of%20separated%20pulmonary%20and%20systemic%20circulation%20in%20vertebrates%2C%20via%20cardiac%20outflow%20tract%20%28OFT%29%20septation%2C%20is%20a%20sensitive%20developmental%20process%20accounting%20for%2010%25%20of%20all%20congenital%20anomalies.%20Neural%20Crest%20Cells%20%28NCC%29%20colonising%20the%20heart%20condensate%20along%20the%20primitive%20endocardial%20tube%20and%20force%20its%20scission%20into%20two%20tubes.%20Here%2C%20we%20show%20that%20NCC%20aggregation%20progressively%20decreases%20along%20the%20OFT%20distal-proximal%20axis%20following%20a%20BMP%20signalling%20gradient.%20Dullard%2C%20a%20nuclear%20phosphatase%2C%20tunes%20the%20BMP%20gradient%20amplitude%20and%20prevents%20NCC%20premature%20condensation.%20Dullard%20maintains%20transcriptional%20programs%20providing%20NCC%20with%20mesenchymal%20traits.%20It%20attenuates%20the%20expression%20of%20the%20aggregation%20factor%20Sema3c%20and%20conversely%20promotes%20that%20of%20the%20epithelial-mesenchymal%20transition%20driver%20Twist1.%20Altogether%2C%20Dullard-mediated%20fine-tuning%20of%20BMP%20signalling%20ensures%20the%20timed%20and%20progressive%20zipper-like%20closure%20of%20the%20OFT%20by%20the%20NCC%20and%20prevents%20the%20formation%20of%20a%20heart%20carrying%20the%20congenital%20abnormalities%20defining%20the%20tetralogy%20of%20Fallot.%22%2C%22date%22%3A%222020-02-27%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.7554%5C%2FeLife.50325%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%222050-084X%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22SWPJ8ZNP%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Yvernogeau%20et%20al.%22%2C%22parsedDate%22%3A%222019-11%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BYvernogeau%2C%20L.%2C%20Gautier%2C%20R.%2C%20Petit%2C%20L.%2C%20Khoury%2C%20H.%2C%20Relaix%2C%20F.%2C%20Ribes%2C%20V.%2C%20Sang%2C%20H.%2C%20Charbord%2C%20P.%2C%20Souyri%2C%20M.%2C%20Robin%2C%20C.%2C%20%26amp%3B%20Jaffredo%2C%20T.%20%282019%29.%20In%20vivo%20generation%20of%20haematopoietic%20stem%5C%2Fprogenitor%20cells%20from%20bone%20marrow-derived%20haemogenic%20endothelium.%20%26lt%3Bi%26gt%3BNature%20Cell%20Biology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B21%26lt%3B%5C%2Fi%26gt%3B%2811%29%2C%201334%26%23×2013%3B1345.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41556-019-0410-6%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fs41556-019-0410-6%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22In%20vivo%20generation%20of%20haematopoietic%20stem%5C%2Fprogenitor%20cells%20from%20bone%20marrow-derived%20haemogenic%20endothelium%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Laurent%22%2C%22lastName%22%3A%22Yvernogeau%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Rodolphe%22%2C%22lastName%22%3A%22Gautier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Laurence%22%2C%22lastName%22%3A%22Petit%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Hanane%22%2C%22lastName%22%3A%22Khoury%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Relaix%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Helen%22%2C%22lastName%22%3A%22Sang%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Pierre%22%2C%22lastName%22%3A%22Charbord%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Mich%5Cu00e8le%22%2C%22lastName%22%3A%22Souyri%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Catherine%22%2C%22lastName%22%3A%22Robin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Thierry%22%2C%22lastName%22%3A%22Jaffredo%22%7D%5D%2C%22abstractNote%22%3A%22It%20is%20well%20established%20that%20haematopoietic%20stem%20and%20progenitor%20cells%20%28HSPCs%29%20are%20generated%20from%20a%20transient%20subset%20of%20specialized%20endothelial%20cells%20termed%20haemogenic%2C%20present%20in%20the%20yolk%20sac%2C%20placenta%20and%20aorta%2C%20through%20an%20endothelial-to-haematopoietic%20transition%20%28EHT%29.%20HSPC%20generation%20via%20EHT%20is%20thought%20to%20be%20restricted%20to%20the%20early%20stages%20of%20development.%20By%20using%20experimental%20embryology%20and%20genetic%20approaches%20in%20birds%20and%20mice%2C%20respectively%2C%20we%20document%20here%20the%20discovery%20of%20a%20bone%20marrow%20haemogenic%20endothelium%20in%20the%20late%20fetus%5C%2Fyoung%20adult.%20These%20cells%20are%20capable%20of%20de%20novo%20producing%20a%20cohort%20of%20HSPCs%20in%20situ%20that%20harbour%20a%20very%20specific%20molecular%20signature%20close%20to%20that%20of%20aortic%20endothelial%20cells%20undergoing%20EHT%20or%20their%20immediate%20progenies%2C%20i.e.%2C%20recently%20emerged%20HSPCs.%20Taken%20together%2C%20our%20results%20reveal%20that%20HSPCs%20can%20be%20generated%20de%20novo%20past%20embryonic%20stages.%20Understanding%20the%20molecular%20events%20controlling%20this%20production%20will%20be%20critical%20for%20devising%20innovative%20therapies.%22%2C%22date%22%3A%222019-11%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1038%5C%2Fs41556-019-0410-6%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221476-4679%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22VVE3K6R4%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Duval%20et%20al.%22%2C%22parsedDate%22%3A%222019-07-25%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BDuval%2C%20N.%2C%20Vaslin%2C%20C.%2C%20Barata%2C%20T.%20C.%2C%20Frarma%2C%20Y.%2C%20Contremoulins%2C%20V.%2C%20Baudin%2C%20X.%2C%20Nedelec%2C%20S.%2C%20%26amp%3B%20Ribes%2C%20V.%20C.%20%282019%29.%20BMP4%20patterns%20Smad%20activity%20and%20generates%20stereotyped%20cell%20fate%20organization%20in%20spinal%20organoids.%20%26lt%3Bi%26gt%3BDevelopment%20%28Cambridge%2C%20England%29%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B146%26lt%3B%5C%2Fi%26gt%3B%2814%29%2C%20dev175430.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fdev.175430%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fdev.175430%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22BMP4%20patterns%20Smad%20activity%20and%20generates%20stereotyped%20cell%20fate%20organization%20in%20spinal%20organoids%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nathalie%22%2C%22lastName%22%3A%22Duval%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%5Cu00e9lia%22%2C%22lastName%22%3A%22Vaslin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Tiago%20C.%22%2C%22lastName%22%3A%22Barata%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Youcef%22%2C%22lastName%22%3A%22Frarma%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vincent%22%2C%22lastName%22%3A%22Contremoulins%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Xavier%22%2C%22lastName%22%3A%22Baudin%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%20C.%22%2C%22lastName%22%3A%22Ribes%22%7D%5D%2C%22abstractNote%22%3A%22Bone%20morphogenetic%20proteins%20%28BMPs%29%20are%20secreted%20regulators%20of%20cell%20fate%20in%20several%20developing%20tissues.%20In%20the%20embryonic%20spinal%20cord%2C%20they%20control%20the%20emergence%20of%20the%20neural%20crest%2C%20roof%20plate%20and%20distinct%20subsets%20of%20dorsal%20interneurons.%20Although%20a%20gradient%20of%20BMP%20activity%20has%20been%20proposed%20to%20determine%20cell%20type%20identity%20in%20vivo%2C%20whether%20this%20is%20sufficient%20for%20pattern%20formation%20in%20vitro%20is%20unclear.%20Here%2C%20we%20demonstrate%20that%20exposure%20to%20BMP4%20initiates%20distinct%20spatial%20dynamics%20of%20BMP%20signalling%20within%20the%20self-emerging%20epithelia%20of%20both%20mouse%20and%20human%20pluripotent%20stem%20cell-derived%20spinal%20organoids.%20The%20pattern%20of%20BMP%20signalling%20results%20in%20the%20stereotyped%20spatial%20arrangement%20of%20dorsal%20neural%20tube%20cell%20types%2C%20and%20concentration%2C%20timing%20and%20duration%20of%20BMP4%20exposure%20modulate%20these%20patterns.%20Moreover%2C%20differences%20in%20the%20duration%20of%20competence%20time-windows%20between%20mouse%20and%20human%20account%20for%20the%20species-specific%20tempo%20of%20neural%20differentiation.%20Together%2C%20this%20study%20describes%20efficient%20methods%20for%20generating%20patterned%20subsets%20of%20dorsal%20interneurons%20in%20spinal%20organoids%20and%20supports%20the%20conclusion%20that%20graded%20BMP%20activity%20orchestrates%20the%20spatial%20organization%20of%20the%20dorsal%20neural%20tube%20cellular%20diversity%20in%20mouse%20and%20human.%22%2C%22date%22%3A%222019-07-25%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1242%5C%2Fdev.175430%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221477-9129%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A47Z%22%7D%7D%2C%7B%22key%22%3A%22EFD4DE86%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Gerber%20et%20al.%22%2C%22parsedDate%22%3A%222019-02-20%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BGerber%2C%20V.%2C%20Yang%2C%20L.%2C%20Takamiya%2C%20M.%2C%20Ribes%2C%20V.%2C%20Gourain%2C%20V.%2C%20Peravali%2C%20R.%2C%20Stegmaier%2C%20J.%2C%20Mikut%2C%20R.%2C%20Reischl%2C%20M.%2C%20Ferg%2C%20M.%2C%20Rastegar%2C%20S.%2C%20%26amp%3B%20Str%26%23xE4%3Bhle%2C%20U.%20%282019%29.%20The%20HMG%20box%20transcription%20factors%20Sox1a%20and%20Sox1b%20specify%20a%20new%20class%20of%20glycinergic%20interneuron%20in%20the%20spinal%20cord%20of%20zebrafish%20embryos.%20%26lt%3Bi%26gt%3BDevelopment%20%28Cambridge%2C%20England%29%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B146%26lt%3B%5C%2Fi%26gt%3B%284%29%2C%20dev172510.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fdev.172510%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1242%5C%2Fdev.172510%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22The%20HMG%20box%20transcription%20factors%20Sox1a%20and%20Sox1b%20specify%20a%20new%20class%20of%20glycinergic%20interneuron%20in%20the%20spinal%20cord%20of%20zebrafish%20embryos%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Gerber%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lixin%22%2C%22lastName%22%3A%22Yang%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Masanari%22%2C%22lastName%22%3A%22Takamiya%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Victor%22%2C%22lastName%22%3A%22Gourain%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ravindra%22%2C%22lastName%22%3A%22Peravali%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Johannes%22%2C%22lastName%22%3A%22Stegmaier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Ralf%22%2C%22lastName%22%3A%22Mikut%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Markus%22%2C%22lastName%22%3A%22Reischl%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Marco%22%2C%22lastName%22%3A%22Ferg%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Sepand%22%2C%22lastName%22%3A%22Rastegar%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Uwe%22%2C%22lastName%22%3A%22Str%5Cu00e4hle%22%7D%5D%2C%22abstractNote%22%3A%22Specification%20of%20neurons%20in%20the%20spinal%20cord%20relies%20on%20extrinsic%20and%20intrinsic%20signals%2C%20which%20in%20turn%20are%20interpreted%20by%20expression%20of%20transcription%20factors.%20V2%20interneurons%20develop%20from%20the%20ventral%20aspects%20of%20the%20spinal%20cord.%20We%20report%20here%20a%20novel%20neuronal%20V2%20subtype%2C%20named%20V2s%2C%20in%20zebrafish%20embryos.%20Formation%20of%20these%20neurons%20depends%20on%20the%20transcription%20factors%20sox1a%20and%20sox1b.%20They%20develop%20from%20common%20gata2a-%20and%20gata3-dependent%20precursors%20co-expressing%20markers%20of%20V2b%20and%20V2s%20interneurons.%20Chemical%20blockage%20of%20Notch%20signalling%20causes%20a%20decrease%20in%20V2s%20and%20an%20increase%20in%20V2b%20cells.%20Our%20results%20are%20consistent%20with%20the%20existence%20of%20at%20least%20two%20types%20of%20precursor%20arranged%20in%20a%20hierarchical%20manner%20in%20the%20V2%20domain.%20V2s%20neurons%20grow%20long%20ipsilateral%20descending%20axonal%20projections%20with%20a%20short%20branch%20at%20the%20ventral%20midline.%20They%20acquire%20a%20glycinergic%20neurotransmitter%20type%20during%20the%20second%20day%20of%20development.%20Unilateral%20ablation%20of%20V2s%20interneurons%20causes%20a%20delay%20in%20touch-provoked%20escape%20behaviour%2C%20suggesting%20that%20V2s%20interneurons%20are%20involved%20in%20fast%20motor%20responses.%22%2C%22date%22%3A%222019-02-20%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1242%5C%2Fdev.172510%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221477-9129%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22ZNSWE8IB%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Gard%20et%20al.%22%2C%22parsedDate%22%3A%222017-12-01%22%2C%22numChildren%22%3A2%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BGard%2C%20C.%2C%20Gonzalez%20Curto%2C%20G.%2C%20Frarma%2C%20Y.%20E.-M.%2C%20Chollet%2C%20E.%2C%20Duval%2C%20N.%2C%20Auzi%26%23xE9%3B%2C%20V.%2C%20Aurad%26%23xE9%3B%2C%20F.%2C%20Vigier%2C%20L.%2C%20Relaix%2C%20F.%2C%20Pierani%2C%20A.%2C%20Causeret%2C%20F.%2C%20%26amp%3B%20Ribes%2C%20V.%20%282017%29.%20Pax3-%20and%20Pax7-mediated%20Dbx1%20regulation%20orchestrates%20the%20patterning%20of%20intermediate%20spinal%20interneurons.%20%26lt%3Bi%26gt%3BDevelopmental%20Biology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B432%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%2024%26%23×2013%3B33.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.ydbio.2017.06.014%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1016%5C%2Fj.ydbio.2017.06.014%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Pax3-%20and%20Pax7-mediated%20Dbx1%20regulation%20orchestrates%20the%20patterning%20of%20intermediate%20spinal%20interneurons%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Chris%22%2C%22lastName%22%3A%22Gard%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Gloria%22%2C%22lastName%22%3A%22Gonzalez%20Curto%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Youcef%20El-Mokhtar%22%2C%22lastName%22%3A%22Frarma%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Elodie%22%2C%22lastName%22%3A%22Chollet%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nathalie%22%2C%22lastName%22%3A%22Duval%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Valentine%22%2C%22lastName%22%3A%22Auzi%5Cu00e9%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Aurad%5Cu00e9%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Lisa%22%2C%22lastName%22%3A%22Vigier%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Relaix%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Alessandra%22%2C%22lastName%22%3A%22Pierani%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Fr%5Cu00e9d%5Cu00e9ric%22%2C%22lastName%22%3A%22Causeret%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vanessa%22%2C%22lastName%22%3A%22Ribes%22%7D%5D%2C%22abstractNote%22%3A%22Transcription%20factors%20are%20key%20orchestrators%20of%20the%20emergence%20of%20neuronal%20diversity%20within%20the%20developing%20spinal%20cord.%20As%20such%2C%20the%20two%20paralogous%20proteins%20Pax3%20and%20Pax7%20regulate%20the%20specification%20of%20progenitor%20cells%20within%20the%20intermediate%20neural%20tube%2C%20by%20defining%20a%20neat%20segregation%20between%20those%20fated%20to%20form%20motor%20circuits%20and%20those%20involved%20in%20the%20integration%20of%20sensory%20inputs.%20To%20attain%20insights%20into%20the%20molecular%20means%20by%20which%20they%20control%20this%20process%2C%20we%20have%20performed%20detailed%20phenotypic%20analyses%20of%20the%20intermediate%20spinal%20interneurons%20%28IN%29%2C%20namely%20the%20dI6%2C%20V0D%2C%20V0VCG%20and%20V1%20populations%20in%20compound%20null%20mutants%20for%20Pax3%20and%20Pax7.%20This%20has%20revealed%20that%20the%20levels%20of%20Pax3%5C%2F7%20proteins%20determine%20both%20the%20dorso-ventral%20extent%20and%20the%20number%20of%20cells%20produced%20in%20each%20subpopulation%3B%20with%20increasing%20levels%20leading%20to%20the%20dorsalisation%20of%20their%20fate.%20Furthermore%2C%20thanks%20to%20the%20examination%20of%20mutants%20in%20which%20Pax3%20transcriptional%20activity%20is%20skewed%20either%20towards%20repression%20or%20activation%2C%20we%20demonstrate%20that%20this%20cell%20diversification%20process%20is%20mainly%20dictated%20by%20Pax3%5C%2F7%20ability%20to%20repress%20gene%20expression.%20Consistently%2C%20we%20show%20that%20Pax3%20and%20Pax7%20inhibit%20the%20expression%20of%20Dbx1%20and%20of%20its%20repressor%20Prdm12%2C%20fate%20determinants%20of%20the%20V0%20and%20V1%20interneurons%2C%20respectively.%20Notably%2C%20we%20provide%20evidence%20for%20the%20activity%20of%20several%20cis-regulatory%20modules%20of%20Dbx1%20to%20be%20sensitive%20to%20Pax3%20and%20Pax7%20transcriptional%20activity%20levels.%20Altogether%2C%20our%20study%20provides%20insights%20into%20how%20the%20redundancy%20within%20a%20TF%20family%2C%20together%20with%20discrete%20dynamics%20of%20expression%20profiles%20of%20each%20member%2C%20are%20exploited%20to%20generate%20cellular%20diversity.%20Furthermore%2C%20our%20data%20supports%20the%20model%20whereby%20cell%20fate%20choices%20in%20the%20neural%20tube%20do%20not%20rely%20on%20binary%20decisions%20but%20rather%20on%20inhibition%20of%20multiple%20alternative%20fates.%22%2C%22date%22%3A%222017-12-01%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1016%5C%2Fj.ydbio.2017.06.014%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221095-564X%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A48Z%22%7D%7D%2C%7B%22key%22%3A%22JCKGD53A%22%2C%22library%22%3A%7B%22id%22%3A2913254%7D%2C%22meta%22%3A%7B%22creatorSummary%22%3A%22Maury%20et%20al.%22%2C%22parsedDate%22%3A%222015-01%22%2C%22numChildren%22%3A1%7D%2C%22bib%22%3A%22%26lt%3Bdiv%20class%3D%26quot%3Bcsl-bib-body%26quot%3B%20style%3D%26quot%3Bline-height%3A%202%3B%20padding-left%3A%201em%3B%20text-indent%3A-1em%3B%26quot%3B%26gt%3B%5Cn%20%20%26lt%3Bdiv%20class%3D%26quot%3Bcsl-entry%26quot%3B%26gt%3BMaury%2C%20Y.%2C%20C%26%23xF4%3Bme%2C%20J.%2C%20Piskorowski%2C%20R.%20A.%2C%20Salah-Mohellibi%2C%20N.%2C%20Chevaleyre%2C%20V.%2C%20Peschanski%2C%20M.%2C%20Martinat%2C%20C.%2C%20%26amp%3B%20Nedelec%2C%20S.%20%282015%29.%20Combinatorial%20analysis%20of%20developmental%20cues%20efficiently%20converts%20human%20pluripotent%20stem%20cells%20into%20multiple%20neuronal%20subtypes.%20%26lt%3Bi%26gt%3BNature%20Biotechnology%26lt%3B%5C%2Fi%26gt%3B%2C%20%26lt%3Bi%26gt%3B33%26lt%3B%5C%2Fi%26gt%3B%281%29%2C%2089%26%23×2013%3B96.%20%26lt%3Ba%20class%3D%26%23039%3Bzp-DOIURL%26%23039%3B%20href%3D%26%23039%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fnbt.3049%26%23039%3B%26gt%3Bhttps%3A%5C%2F%5C%2Fdoi.org%5C%2F10.1038%5C%2Fnbt.3049%26lt%3B%5C%2Fa%26gt%3B%26lt%3B%5C%2Fdiv%26gt%3B%5Cn%26lt%3B%5C%2Fdiv%26gt%3B%22%2C%22data%22%3A%7B%22itemType%22%3A%22journalArticle%22%2C%22title%22%3A%22Combinatorial%20analysis%20of%20developmental%20cues%20efficiently%20converts%20human%20pluripotent%20stem%20cells%20into%20multiple%20neuronal%20subtypes%22%2C%22creators%22%3A%5B%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Yves%22%2C%22lastName%22%3A%22Maury%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Julien%22%2C%22lastName%22%3A%22C%5Cu00f4me%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Rebecca%20A.%22%2C%22lastName%22%3A%22Piskorowski%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Nouzha%22%2C%22lastName%22%3A%22Salah-Mohellibi%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Vivien%22%2C%22lastName%22%3A%22Chevaleyre%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22Marc%22%2C%22lastName%22%3A%22Peschanski%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22C%5Cu00e9cile%22%2C%22lastName%22%3A%22Martinat%22%7D%2C%7B%22creatorType%22%3A%22author%22%2C%22firstName%22%3A%22St%5Cu00e9phane%22%2C%22lastName%22%3A%22Nedelec%22%7D%5D%2C%22abstractNote%22%3A%22Specification%20of%20cell%20identity%20during%20development%20depends%20on%20exposure%20of%20cells%20to%20sequences%20of%20extrinsic%20cues%20delivered%20at%20precise%20times%20and%20concentrations.%20Identification%20of%20combinations%20of%20patterning%20molecules%20that%20control%20cell%20fate%20is%20essential%20for%20the%20effective%20use%20of%20human%20pluripotent%20stem%20cells%20%28hPSCs%29%20for%20basic%20and%20translational%20studies.%20Here%20we%20describe%20a%20scalable%2C%20automated%20approach%20to%20systematically%20test%20the%20combinatorial%20actions%20of%20small%20molecules%20for%20the%20targeted%20differentiation%20of%20hPSCs.%20Applied%20to%20the%20generation%20of%20neuronal%20subtypes%2C%20this%20analysis%20revealed%20an%20unappreciated%20role%20for%20canonical%20Wnt%20signaling%20in%20specifying%20motor%20neuron%20diversity%20from%20hPSCs%20and%20allowed%20us%20to%20define%20rapid%20%2814%20days%29%2C%20efficient%20procedures%20to%20generate%20spinal%20and%20cranial%20motor%20neurons%20as%20well%20as%20spinal%20interneurons%20and%20sensory%20neurons.%20Our%20systematic%20approach%20to%20improving%20hPSC-targeted%20differentiation%20should%20facilitate%20disease%20modeling%20studies%20and%20drug%20screening%20assays.%22%2C%22date%22%3A%222015-01%22%2C%22section%22%3A%22%22%2C%22partNumber%22%3A%22%22%2C%22partTitle%22%3A%22%22%2C%22DOI%22%3A%2210.1038%5C%2Fnbt.3049%22%2C%22citationKey%22%3A%22%22%2C%22url%22%3A%22%22%2C%22PMID%22%3A%22%22%2C%22PMCID%22%3A%22%22%2C%22ISSN%22%3A%221546-1696%22%2C%22language%22%3A%22eng%22%2C%22collections%22%3A%5B%22MIYUW3RH%22%5D%2C%22dateModified%22%3A%222025-02-11T10%3A55%3A47Z%22%7D%7D%5D%7D
Rondon, R., Hezez, T., Albert, J. R., Hayashi, S., Drayton-Libotte, B., Curto, G. G., Auradé, F., Balloul, E., Dugast-Darzacq, C., Relaix, F., Gilardi-Hebenstreit, P., & Ribes, V. (2025). Dual transcriptional activities of PAX3 and PAX7 spatially encode spinal cell fates through distinct gene networks.
PLOS Biology,
23(10), e3003448.
https://doi.org/10.1371/journal.pbio.3003448
Paillard, T., Allam, A., Doulazmi, M., Hautefeuille, M., Fouquet, C., Sarde, L., Stoufflet, J., Messaoudi, S., Spassky, N., Nédélec, S., Dusart, I., Trembleau, A., & Isabelle Caillé. (2025). GPR161 mechanosensitivity at the primary cilium drives neuronal saltatory migration.
Science Advances,
11(31), eadx3846.
https://doi.org/10.1126/sciadv.adx3846
Huchede, P., Meyer, S., Berthelot, C., Hamadou, M., Bertrand-Chapel, A., Rakotomalala, A., Manceau, L., Tomine, J., Lespinasse, N., Lewandowski, P., Cordier-Bussat, M., Broutier, L., Dutour, A., Rochet, I., Blay, J.-Y., Degletagne, C., Attignon, V., Montero-Carcaboso, A., Le Grand, M., … Castets, M. (2024). BMP2 and BMP7 cooperate with H3.3K27M to promote quiescence and invasiveness in pediatric diffuse midline gliomas.
eLife,
12, RP91313.
https://doi.org/10.7554/eLife.91313
Rodríguez-Martín, M., Báez-Flores, J., Ribes, V., Isidoro-García, M., Lacal, J., & Prieto-Matos, P. (2024). Non-Mammalian Models for Understanding Neurological Defects in RASopathies.
Biomedicines,
12(4), 841.
https://doi.org/10.3390/biomedicines12040841
Mirdass, C., Catala, M., Bocel, M., Nedelec, S., & Ribes, V. (2023). Stem cell-derived models of spinal neurulation.
Emerging Topics in Life Sciences,
7(4), 423–437.
https://doi.org/10.1042/ETLS20230087
Gribaudo, S., Robert, R., van Sambeek, B., Mirdass, C., Lyubimova, A., Bouhali, K., Ferent, J., Morin, X., van Oudenaarden, A., & Nedelec, S. (2023). Self-organizing models of human trunk organogenesis recapitulate spinal cord and spine co-morphogenesis.
Nature Biotechnology.
https://doi.org/10.1038/s41587-023-01956-9
Liau, E. S., Jin, S., Chen, Y.-C., Liu, W.-S., Calon, M., Nedelec, S., Nie, Q., & Chen, J.-A. (2023). Single-cell transcriptomic analysis reveals diversity within mammalian spinal motor neurons.
Nature Communications,
14(1), 46.
https://doi.org/10.1038/s41467-022-35574-x
Manceau, L., Richard Albert, J., Lollini, P.-L., Greenberg, M. V. C., Gilardi-Hebenstreit, P., & Ribes, V. (2022). Divergent transcriptional and transforming properties of PAX3-FOXO1 and PAX7-FOXO1 paralogs.
PLoS Genetics,
18(5), e1009782.
https://doi.org/10.1371/journal.pgen.1009782
Mouilleau, V., Vaslin, C., Robert, R., Gribaudo, S., Nicolas, N., Jarrige, M., Terray, A., Lesueur, L., Mathis, M. W., Croft, G., Daynac, M., Rouiller-Fabre, V., Wichterle, H., Ribes, V., Martinat, C., & Nedelec, S. (2021). Dynamic extrinsic pacing of the HOX clock in human axial progenitors controls motor neuron subtype specification.
Development (Cambridge, England),
148(6), dev194514.
https://doi.org/10.1242/dev.194514
Nedelec, S., & Martinez-Arias, A. (2021). In vitro models of spinal motor circuit’s development in mammals: achievements and challenges.
Current Opinion in Neurobiology,
66, 240–249.
https://doi.org/10.1016/j.conb.2020.12.002
Gonzalez Curto, G., Der Vartanian, A., Frarma, Y. E.-M., Manceau, L., Baldi, L., Prisco, S., Elarouci, N., Causeret, F., Korenkov, D., Rigolet, M., Aurade, F., De Reynies, A., Contremoulins, V., Relaix, F., Faklaris, O., Briscoe, J., Gilardi-Hebenstreit, P., & Ribes, V. (2020). The PAX-FOXO1s trigger fast trans-differentiation of chick embryonic neural cells into alveolar rhabdomyosarcoma with tissue invasive properties limited by S phase entry inhibition.
PLoS Genetics,
16(11), e1009164.
https://doi.org/10.1371/journal.pgen.1009164
Kumamoto, T., Maurinot, F., Barry-Martinet, R., Vaslin, C., Vandormael-Pournin, S., Le, M., Lerat, M., Niculescu, D., Cohen-Tannoudji, M., Rebsam, A., Loulier, K., Nedelec, S., Tozer, S., & Livet, J. (2020). Direct Readout of Neural Stem Cell Transgenesis with an Integration-Coupled Gene Expression Switch.
Neuron,
107(4), 617-630.e6.
https://doi.org/10.1016/j.neuron.2020.05.038
Darrigrand, J.-F., Valente, M., Comai, G., Martinez, P., Petit, M., Nishinakamura, R., Osorio, D. S., Renault, G., Marchiol, C., Ribes, V., & Cadot, B. (2020). Dullard-mediated Smad1/5/8 inhibition controls mouse cardiac neural crest cells condensation and outflow tract septation.
eLife,
9, e50325.
https://doi.org/10.7554/eLife.50325
Yvernogeau, L., Gautier, R., Petit, L., Khoury, H., Relaix, F., Ribes, V., Sang, H., Charbord, P., Souyri, M., Robin, C., & Jaffredo, T. (2019). In vivo generation of haematopoietic stem/progenitor cells from bone marrow-derived haemogenic endothelium.
Nature Cell Biology,
21(11), 1334–1345.
https://doi.org/10.1038/s41556-019-0410-6
Duval, N., Vaslin, C., Barata, T. C., Frarma, Y., Contremoulins, V., Baudin, X., Nedelec, S., & Ribes, V. C. (2019). BMP4 patterns Smad activity and generates stereotyped cell fate organization in spinal organoids.
Development (Cambridge, England),
146(14), dev175430.
https://doi.org/10.1242/dev.175430
Gerber, V., Yang, L., Takamiya, M., Ribes, V., Gourain, V., Peravali, R., Stegmaier, J., Mikut, R., Reischl, M., Ferg, M., Rastegar, S., & Strähle, U. (2019). The HMG box transcription factors Sox1a and Sox1b specify a new class of glycinergic interneuron in the spinal cord of zebrafish embryos.
Development (Cambridge, England),
146(4), dev172510.
https://doi.org/10.1242/dev.172510
Gard, C., Gonzalez Curto, G., Frarma, Y. E.-M., Chollet, E., Duval, N., Auzié, V., Auradé, F., Vigier, L., Relaix, F., Pierani, A., Causeret, F., & Ribes, V. (2017). Pax3- and Pax7-mediated Dbx1 regulation orchestrates the patterning of intermediate spinal interneurons.
Developmental Biology,
432(1), 24–33.
https://doi.org/10.1016/j.ydbio.2017.06.014
Maury, Y., Côme, J., Piskorowski, R. A., Salah-Mohellibi, N., Chevaleyre, V., Peschanski, M., Martinat, C., & Nedelec, S. (2015). Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes.
Nature Biotechnology,
33(1), 89–96.
https://doi.org/10.1038/nbt.3049
Thèses
Robin Rondon, « De la répression à l’activation : Le double jeu transcriptionnel de PAX3 et PAX7 au cours de la spécification des neurones de la moelle épinière sensorielle », soutenue le 26 Septembre 2025
- Maeliss Calon, «Etude des bases moléculaires et cellulaires de la vulnérabilité des neurones moteurs dans l’amyotrophie spinale distale des membres inférieurs», soutenue le 26 Septembre 2024
- Rémi Robert, «Etude des mécanismes contrôlant l’expression des gènes HOX et implications pour la génération in vitro de tissus humains», soutenue le 22 Septembre 2023
- Line Manceau, «Etude des mécanismes moléculaires et cellulaires par lesquels les facteurs de transcription paralogues PAX3-FOXO1 et PAX7-FOXO1 exercent leur activité oncogénique», soutenue le 24 Septembre 2021
- Célia Vaslin, «Etude des mécanismes de signalisation cellulaire contrôlant la diversification neuronale dans la moelle épinière», soutenue le 26 Mars 2021
- Vincent Mouilleau, «Etude des mécanismes du développement de la moelle épinière humaine par la mise en place de modèles in vitro dérivés de cellules souches pluripotentes humaines», soutenue 26 Novembre 2019
Collaborations
- Nicolas Borghi (IJM)
- Valérie Doye (IJM)
- Alexandre Baffet (Institut Curie, France)
- Nadia Bahi-Buisson (Institut Imagine, France)
- Bertrand Bénazéraf (Centre de Biologie Intégrative, CBI, France)
- Jésus Lacal (University of Salamanca, Spain)
- Marie Castets (Centre de Recherche en Cancérologie de Lyon, CRCL, Lyon)
- Valérie Dupé (Institut Génétique & Développement de Rennes, IGDR, Rennes)
- Fiona Francis (Institut du Fer à Moulin, IFM, France)
- Eddy Pasquier (Centre de Recherche en Cancérologie de Marseille, CRCM, Marseille)
- Alessandra Pierani (Institut Imagine, France)
- Benoit Sorre (Institut Curie, France)
- Hynek Wichterle (Columbia University, New York, USA)
- Odil Porrua (IGMM, Montpellier, France)
Financements
- INSERM
- ERC
- Ligue Nationale Contre le Cancer
- Agence Nationale de la Recherche
- Fondation pour la Recherche Médicale
- L’association WonderAugustine
- Financement “Emergence en recherche” (Université Paris Cité)
- PEPR Cell-ID
- ibio Sorbonne université
- GIS FC3R
Actualité
Emploi
Postes Post-Doctoraux
Nous recherchons des candidat(e)s post-doctorant(e)s intéressé(e)s par l’étude de la régulation transcriptionnelle des décisions de destin cellulaire, avec une expertise en culture de cellules iPSC ou en bioinformatique. Les candidat(e)s doivent envoyer leur CV, une lettre de motivation et les coordonnées de 2 à 3 référents à l’adresse suivante : stephane.nedelec@ijm.fr.
Étudiants en Master
Nous recherchons actuellement un(e) étudiant(e) de Master 2, intéressé(e) par la régulation des états de la chromatine pendant le développement neural (stephane.nedelec@ijm.fr) ou l’émergence du rhabdomyosarcome (vanessa.ribes@ijm.fr).

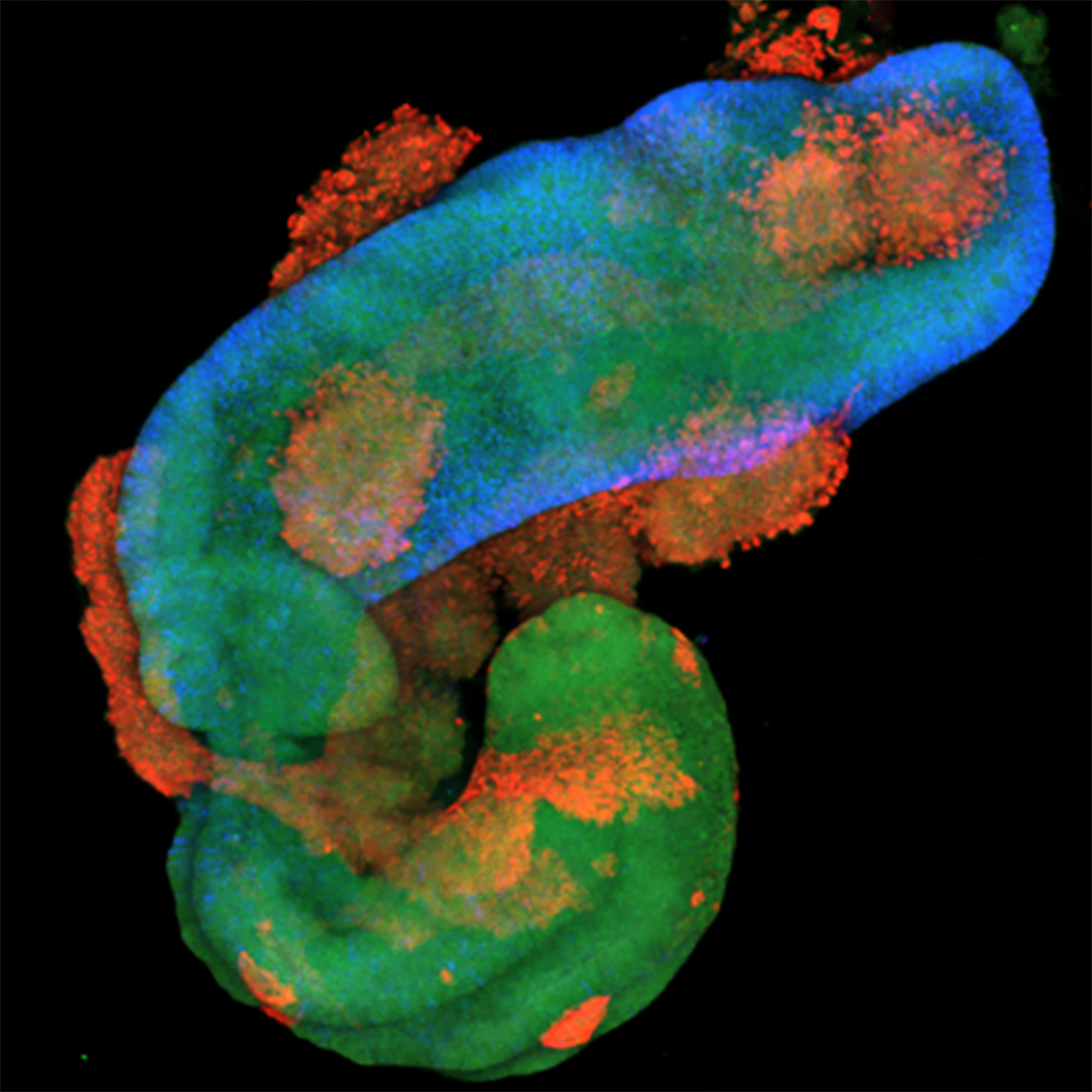


 Stephane NEDELEC, Researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 91, bureau 583B
Stephane NEDELEC, Researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 91, bureau 583B Vanessa RIBES, Researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Vanessa RIBES, Researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Asna ABDOU, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Asna ABDOU, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Ada ALLAM, Postdoctoral researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Ada ALLAM, Postdoctoral researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Marine ALVES, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Marine ALVES, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Kenza CHERIET, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Kenza CHERIET, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Lucas DENIS, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Lucas DENIS, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Claire DUGAST, Assistant Professor, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Claire DUGAST, Assistant Professor, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Pascale GILARDI HEBENSTREIT, Researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Pascale GILARDI HEBENSTREIT, Researcher, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Marine GRISON, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Marine GRISON, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Grace HENSTONE, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Grace HENSTONE, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Theaud HEZEZ, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Theaud HEZEZ, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Helena MALEK, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Helena MALEK, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Camil MIRDASS, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Camil MIRDASS, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Carla RODRIGUEZ-VILLA, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Carla RODRIGUEZ-VILLA, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Robin RONDON, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B
Robin RONDON, PhD student, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 590B Manon SAEZ, Intern, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Manon SAEZ, Intern, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B Elisa SPIELMANN, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B
Elisa SPIELMANN, Biology engineer, RIBES/NEDELEC LAB+33 (0)1 57 27 81 93, bureau 583B

