Dynamique des membranes et trafic intracellulaire
CATHY JACKSON & JEAN-MARC VERBAVATZ
Les cellules eucaryotes sont caractérisées par leurs compartiments endomembranaires (organites), qui permettent à différents processus cellulaires de se dérouler dans un environnement bien adapté. Cependant, pour le fonctionnement de la cellule, les différents organites membranaires et la membrane plasmique doivent communiquer par le biais du trafic vésiculaire et non-vésiculaire. Notre équipe étudie les voies de trafic intracellulaire de lipides, dont la perturbation conduit à diverses pathologies humaines telles que le cancer, le diabète et les maladies neurodégénératives. Ces voies sont également exploitées par de nombreux virus, dont l’hépatite C et le SRAS-CoV-2, pour leur propagation.
Mots-clés : Organite, trafic membranaire, site de contact membranaire, polarité, lipide, réticulum endoplasmique, Golgi, membrane plasmique
+33 (0)1 57 27 80 04 Contact Cathy JACSKON / Jean-Marc VERBAVATZ
Les cellules eucaryotes sont caractérisées par leurs compartiments endomembranaires (organites), qui permettent à différents processus cellulaires de se dérouler dans un environnement bien adapté. Cependant, pour le fonctionnement de la cellule, les différents organites membranaires, comme le réticulum endoplasmique (RE), l’appareil de Golgi, les endosomes, les gouttelettes lipidiques et les mitochondries, et la membrane plasmique communiquent par le biais du trafic vésiculaire et non vésiculaire (Jackson, Walch et Verbavatz, 2016 ; Kaczmarek, Verbavatz et Jackson, 2017 ; Jackson 2019). Dans le trafic vésiculaire, des vésicules sont transportées d’un compartiment donneur vers leur cible, tandis que le trafic non vésiculaire se produit à des sites de contact membranaires (MCS) entre les organites, où les membranes des deux organites sont apposés sans fusion à une distance de 10-30 nm. Le transport des lipides peut être vésiculaire ou non vésiculaire, mais le maintien de la composition lipidique des membranes nécessite un transfert de lipides au niveau des MCS (Jackson, Walch et Verbavatz, 2016). La perturbation du trafic des lipides conduit à diverses pathologies humaines telles que le cancer, le diabète et les maladies neurodégénératives. Ces voies sont également exploitées par de nombreux virus, dont l’hépatite C et le SRAS-CoV-2, pour leur propagation.
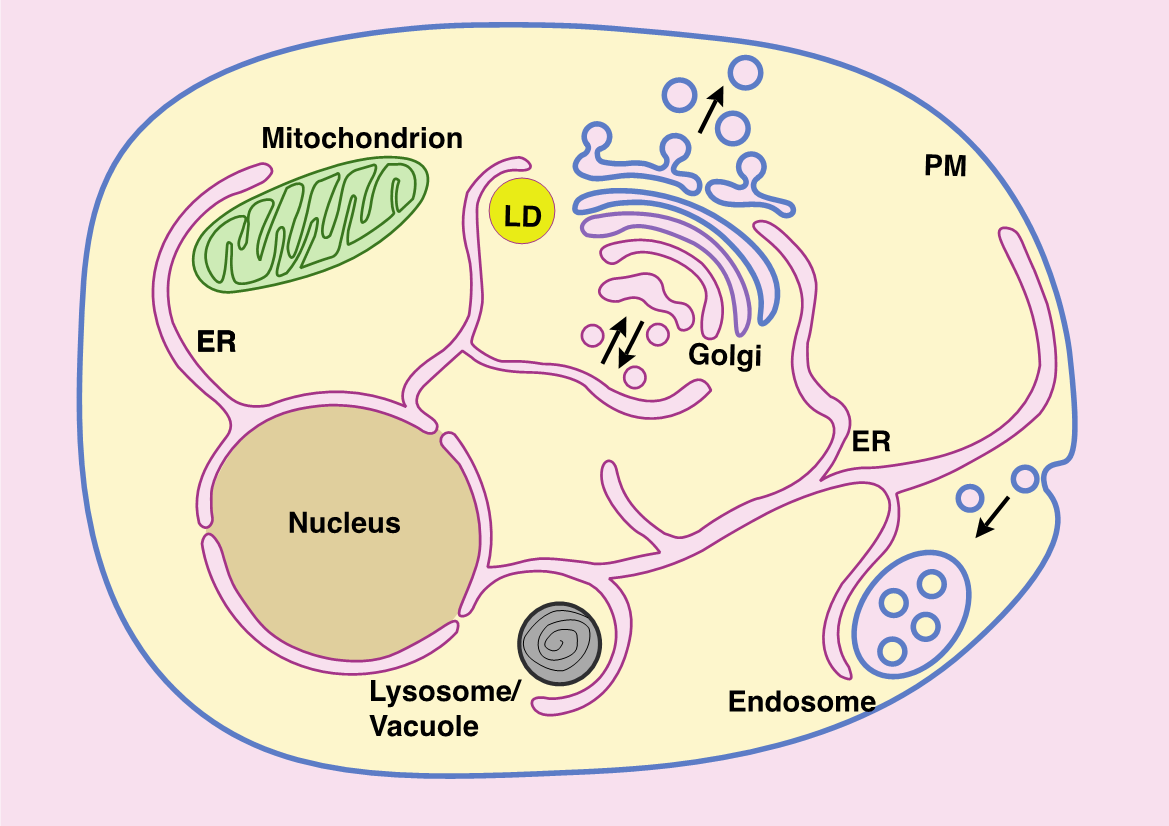
Figure 1. Schéma des principaux organites et sites de contact membranaire dans une cellule eucaryote. RE, réticulum endoplasmique; PM, membrane plasmique; LD, gouttelette lipidique (adapté de Jackson, Walch et Verbavatz, 2016).
Nous utilisons une approche multidisciplinaire utilisant l’imagerie de pointe (microscopie photonique et électronique, imagerie en cellules vivantes), des approches biochimiques et des analyses protéomiques, pour explorer les questions suivantes:
1) Régulation de la dynamique des organites par les GTPases de la famille Arf.
Les protéines de la famille Arf sont des régulateurs clefs de la dynamique membranaire des cellules eucaryotes, ayant des fonctions essentielles pour de multiples organites, dans le trafic vésiculaire et au niveau des MCS. Depuis des années, notre équipe étudie la petite protéine G (GTPase) ADP ribosylation factor 1 (Arf1) et ses activateurs (Donaldson et Jackson 2011), et a découvert de nouvelles fonctions pour ces régulateurs.
La dynamique des organites dans les cellules dépend de moteurs moléculaires qui lient les compartiments membranaires aux microtubules par l’intermédiaire de protéines adaptatrices et qui les transportent vers l’une ou l’autre extrémité d’un microtubule. Nous avons récemment découvert que la protéine Arf1 et son activateur GBF1 régulent le transport des mitochondries le long des microtubules et leur organisation spatiale dans la cellule (Walch et al. 2018).
Les gouttelettes lipidiques (GL), qui sont les principaux sites de stockage d’énergie des cellules eucaryotes, sont aussi à l’interface des voies de trafic membranaire. Notre groupe a découvert un rôle crucial d’Arf1 et de ses régulateurs dans le recrutement des protéines associées aux GL à la surface des GL (Donaldson et Jackson 2011, Bouvet et al. 2013, Jackson 2019). Nous avons également décrit les mécanismes par lesquels les protéines contenant des hélices amphipathiques telles que les périlipines sont ciblées vers la surface des GL (Donaldson et Jackson 2011, Copic et al. 2018).
Dans de fascinants travaux, des protéines de la famille des Arf ont été récemment identifiées dans des nouvelles lignées d’archées (les archées Asgard), ce qui suggère que ces protéines étaient déjà présentes dans l’ancêtre commun des archées et des eucaryotes. Ainsi, les archées Asgard pourraient être la lignée à l’origine des eucaryotes longtemps recherchée. Nous collaborons avec des experts en bioinformatique, en biophysique et en biologie structurale pour déterminer si ces protéines de la famille Arf des archées Asgard possèdent les caractéristiques des GTPases eucaryotes de la famille Arf, et pour explorer leurs rôles potentiels dans l’eucaryogenèse.
2) Fonctions physiologiques des sites de contact entre le réticulum endoplasmique (RE) et la membrane de l’organite (MCS)
Nos travaux ont démontré les fonctions des MCS dans le transport des lipides du RE vers la membrane plasmique, et leur rôle potentiel dans la croissance de la membrane (Moser von Filseck et al. 2015, Petkovic et al. 2014). Le transport de lipides, dont les phosphoinositides aux MCS, est un déterminant important de la composition lipidique spécifique des membranes cellulaires (Jackson, Walch et Verbavatz, 2016) et il joue un rôle important dans les réarrangements cellulaires qui se produisent au cours des grands processus cellulaires. Notre équipe étudie actuellement la régulation et les fonctions des MCS dans des processus tels que la division cellulaire, la migration cellulaire, les contacts intercellulaires et la polarité apico-basale, ainsi que leur implication dans les maladies humaines.
2.1) MCS et division cellulaire
La division cellulaire s’accompagne de réorganisations importantes des organites cellulaires, qui sont essentielles à son déroulement. Une division incorrecte peut entraîner de nombreuses anomalies, comme l’aneuploïdie et le cancer. Pendant la mitose, les organites membranaires subissent de multiples étapes de désassemblage (membrane nucléaire, appareil de Golgi…), de fragmentation (mitochondries…) et de réorganisation (mitochondries, RE…), suivies de leur réassemblage à la fin de la mitose. Ceci s’accompagne de changements coordonnés dans la distribution des phosphoinositides à la membrane plasmique. Nous étudions la dynamique des MCS dans ce processus, la régulation de leur fonction de transport des lipides et leur rôle dans la chorégraphie des organites membranaires pendant la division cellulaire.
2.2) MCS et polarité des cellules épithéliales
L’établissement et le maintien de la polarité cellulaire sont cruciaux pour les fonctions des épithélia, et sont dérégulés dans des maladies humaines telles que le cancer. Dans les cellules épithéliales polarisées, les phosphoinositides sont des déterminants importants de l’identité de la membrane plasmique apicale et basolatérale. Par exemple, le phosphoinositide PI(3,4,5)P3 est localisé à la membrane plasmique basolatérale, mais exclu de la membrane apicale. Notre objectif est de déchiffrer le rôle des MCS dans la détermination de la composition lipidique des membranes apicales et basolatérales des cellules épithéliales, dans l’établissement et dans le maintien de la polarité cellulaire. En utilisant des approches de biologie cellulaire, nous étudions la distribution membranaire des complexes protéiques aux MCS et des protéines de transfert des lipides, et leur fonction dans l’établissement de la polarité cellulaire.
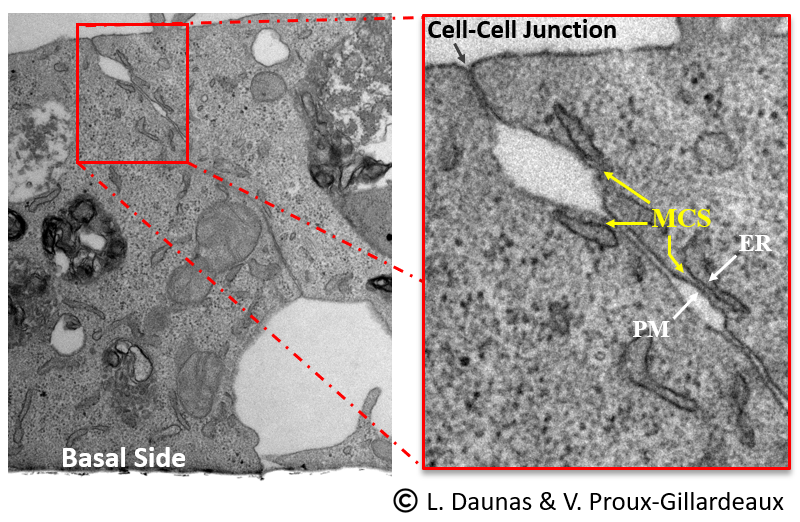 Figure 2. Jonction entre deux cellules épithéliales MDCK montrant la présence de multiples sites de contact RE-membrane plasmique (MCS, flèches jaunes dans l’encadré, panneau de droite). ER, réticulum endoplasmique; PM, membrane plasmique. Crédit photo : L. Daunas et V. Proux-Gillardeaux.
Figure 2. Jonction entre deux cellules épithéliales MDCK montrant la présence de multiples sites de contact RE-membrane plasmique (MCS, flèches jaunes dans l’encadré, panneau de droite). ER, réticulum endoplasmique; PM, membrane plasmique. Crédit photo : L. Daunas et V. Proux-Gillardeaux.
2.3) MCS et motilité cellulaire
La motilité cellulaire dépend étroitement de la distribution des phosphoinositides qui agissent comme des messagers lipidiques dans le remodelage du cytosquelette et la dynamique d’adhésion. Nous étudions le rôle de VAPA, une protéine membranaire d’ancrage des MCS au RE, dans des processus de motilité cellulaire comme la migration, l’adhésion et la mécano-sensibilité. Nous utilisons l’imagerie haute résolution, l’imagerie quantitative et des outils optogénétiques, pour déterminer dans l’espace et le temps comment VAPA aux MCS intervient dans l’échange lipidique et contrôle la motilité cellulaire.
 Figure 3. A. Cellules Caco-2 d’adénocarcinome du côlon en migration. Une cellule « leader » a été suivie pendant plusieurs heures (ligne bleue) au cours d’une expérience de cicatrisation. B. Sites de contact RE-membrane plasmique identifiés par microscopie électronique à l’avant des cellules Caco-2 du front de migration (cases jaunes). C. Nous utilisons des sondes fluorescentes pour étudier la dynamique des MCS pendant la motilité cellulaire. Image prise à l’extrémité du bord antérieur d’une cellule en migration (vert: marqueur RE; magenta: sites de contact RE- membrane plasmique). Crédit photo : M. Heuzé et H. Siegfried.
Figure 3. A. Cellules Caco-2 d’adénocarcinome du côlon en migration. Une cellule « leader » a été suivie pendant plusieurs heures (ligne bleue) au cours d’une expérience de cicatrisation. B. Sites de contact RE-membrane plasmique identifiés par microscopie électronique à l’avant des cellules Caco-2 du front de migration (cases jaunes). C. Nous utilisons des sondes fluorescentes pour étudier la dynamique des MCS pendant la motilité cellulaire. Image prise à l’extrémité du bord antérieur d’une cellule en migration (vert: marqueur RE; magenta: sites de contact RE- membrane plasmique). Crédit photo : M. Heuzé et H. Siegfried.
Responsables
 Catherine JACKSON, Researcher, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 04, bureau 244B
Catherine JACKSON, Researcher, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 04, bureau 244B Jean-Marc VERBAVATZ, Professor, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 04, bureau 244B
Jean-Marc VERBAVATZ, Professor, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 04, bureau 244B
Membres
 Marine ALVES, Biology engineer, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 04, bureau 244B
Marine ALVES, Biology engineer, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 04, bureau 244B Julie BEAUCOUSIN, PhD student, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B
Julie BEAUCOUSIN, PhD student, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B Mélina HEUZE, Assistant Professor, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B
Mélina HEUZE, Assistant Professor, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B Agathe VERRAES, Assistant biology engineer, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B
Agathe VERRAES, Assistant biology engineer, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B Anais VERTUEUX, PhD student, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B
Anais VERTUEUX, PhD student, JACKSON/VERBAVATZ LAB+33 (0)1 57 27 80 05, bureau 244B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
Vargová, R., Chevreau, R., Alves, M., Courbin, C., Terry, K., Legrand, P., Eliáš, M., Ménétrey, J., Dacks, J. B., & Jackson, C. L. (2025). The Asgard archaeal origins of Arf family GTPases involved in eukaryotic organelle dynamics. Nature Microbiology, 1–14. https://doi.org/10.1038/s41564-024-01904-6
Franke C, Repnik U, Segeletz S, Brouilly N, Kalaidzidis Y, Verbavatz JM, Zerial M. Traffic. 2019 Aug;20(8):601-617. doi: 10.1111/tra.12671. PMID: 31206952
GBF1 and Arf1 interact with Miro and regulate mitochondrial positioning within cells.
Walch L, Pellier E, Leng W, Lakisic G, Gautreau A, Contremoulins V, Verbavatz JM#, Jackson CL#. Sci Rep. 2018 Nov 20;8(1):17121. doi: 10.1038/s41598-018-35190-0. PMID: 30459446 #co-corresponding authors
A giant amphipathic helix from a perilipin that is adapted for coating lipid droplets.
Čopič A, Antoine-Bally S, Giménez-Andrés M, La Torre Garay C, Antonny B, Manni MM, Pagnotta S, Guihot J, Jackson CL.Nat Commun. 2018 Apr 6;9(1):1332. doi: 10.1038/s41467-018-03717-8.PMID: 29626194
GBF1 and Arf1 function in vesicular trafficking, lipid homoeostasis and organelle dynamics.
Kaczmarek B, Verbavatz JM, Jackson CL. Biol Cell. 2017 Dec;109(12):391-399. doi: 10.1111/boc.201700042. Epub 2017 Nov 6. PMID: 28985001
Lipids and Their Trafficking: An Integral Part of Cellular Organization.
Jackson CL, Walch L, Verbavatz JM. Dev Cell. 2016 Oct 24;39(2):139-153. doi: 10.1016/j.devcel.2016.09.030. PMID: 27780039 Review.
The SNARE Sec22b has a non-fusogenic function in plasma membrane expansion.
Petkovic M, Jemaiel A, Daste F, Specht CG, Izeddin I, Vorkel D, Verbavatz JM, Darzacq X, Triller A, Pfenninger KH, Tareste D, Jackson CL#, Galli T#. Nat Cell Biol. 2014 May;16(5):434-44. doi: 10.1038/ncb2937. Epub 2014 Apr 6. PMID: 24705552 #co-corresponding authors
Targeting of the Arf-GEF GBF1 to lipid droplets and Golgi membranes.
Bouvet S, Golinelli-Cohen MP, Contremoulins V, Jackson CL.J Cell Sci. 2013 Oct 15;126(Pt 20):4794-805. doi: 10.1242/jcs.134254. Epub 2013 Aug 13.PMID: 23943872
Weber B, Greenan G, Prohaska S, Baum D, Hege HC, Müller-Reichert T, Hyman AA, Verbavatz JM.J Struct Biol. 2012 May;178(2):129-38. doi: 10.1016/j.jsb.2011.12.004. Epub 2011 Dec 13.PMID: 22182731
Pranke IM, Morello V, Bigay J, Gibson K, Verbavatz JM, Antonny B, Jackson CL. J Cell Biol. 2011 Jul 11;194(1):89-103. doi: 10.1083/jcb.201011118. PMID: 21746853
ARF family G proteins and their regulators: roles in membrane transport, development and disease.
Donaldson JG, Jackson CL.Nat Rev Mol Cell Biol. 2011 Jun;12(6):362-75. doi: 10.1038/nrm3117. Epub 2011 May 18.PMID: 21587297
Publications
- 2020, Manuel Giménez Andrés, “Interaction des hélices amphipathiques de la périlipine avec les gouttelettes lipidiques”, Université Paris-Saclay
- 2013, Samuel Bouvet, « Lipides et Trafic : Rôles de GBF1, facteur d’échange de la petite protéine G Arf1 », Université Paris Sud
- 2013, Aymen Jemaiel, « Etude du trafic membranaire vésiculaire et non-vésiculaire chez la levure », Université Paris Sud
- 2011, Iwona M. Pranke “Spécificité du ciblage membranaire par les motifs ALPS et l’α-synucléine”, Université Paris Sud

