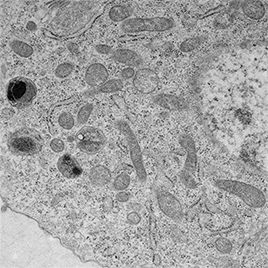
ImagoSeine est la plateforme de service et de R&D (Recherches & Développement) en imagerie de l’Institut Jacques Monod.
Elle propose et développe des prestations de haut niveau permettant la visualisation et l’analyse de la structure, de la dynamique, des interactions et des fonctions des échantillons biologiques. Pour ce faire, la plateforme ImagoSeine de l’Institut Jacques Monod réunit en un même lieu des ressources en cytométrie en flux, microscopie électronique et microscopie photonique.
- La cytométrie en flux permet l’analyse qualitative et quantitative multiparamétrique et multi-couleurs, ainsi que le tri de cellules à haut débit, basés sur la taille, la granulosité, et l’intensité de fluorescence d’éléments en suspension.
- La microscopie électronique permet l’analyse ultrastructurale de la cellule et de ses composants. Elle comprend la microscopie à transmission et la préparation des échantillons à température ambiante ou à basse température.
- La microscopie photonique permet la visualisation et l’analyse de la structure et de processus dynamiques au niveau cellulaire (procaryotes et eucaryotes) et tissulaire. Elle propose des expertises et des équipements innovants, permettant des observations de la molécule unique jusqu’à l’échelle d’un organisme.
La plateforme ImagoSeine de l’Institut Jacques Monod est ouverte à l’ensemble de la communauté scientifique nationale et internationale, publique et privée.
Nos équipements
Informations
Missions
Nous sommes une équipe d’ingénieurs, provenant de disciplines différentes (biologie, physique, informatique), travaillant sur l’interface de la microscopie avec la biologie. Nous proposons :
- l’orientation des utilisateurs vers l’équipement le plus adapté à leur projet.
- l’aide à la conception des outils : biologie moléculaire, étiquetage des protéines, choix des marquages et des fluorophores, protocoles d’analyse …
- l’aide à la mise en place de l’expérience : définition des contrôles, des modes opératoires, des précautions à prendre vis-à-vis des artefacts potentiels.
- l’encadrement éventuel des utilisateurs pour la réalisation des expériences,
- la mise à disposition d’équipements fonctinnels et calibrés.
- la formation des utilisateurs pour une utilisation autonome des équipements.
- la prise en charge des acquisitions pour les utilisateurs non autonomes.
- l’aide au traitement et à l’analyse des données obtenues.
- l’aide à l’interprétation et présentation des résultats.
ImagoSeine est membre de l’infrastructure nationale de recherche dédiée à l’imagerie biologique France-BioImaging et de l’infrastructure européenne Euro-BioImaging.
ImagoSeine bénéficie du soutien des organismes suivants :

Prestations
La plateforme d’imagerie ImagoSeine propose 3 types de prestations en microscopie photonique, cytométrie et microscopie électronique :
1 – l’utilisation autonome des équipements et des réactifs
L’utilisateur autonome est préalablement formé par le personnel de la plateforme sur certains équipements ou pour la réalisation de certaines opérations (voir Formation). Il bénéficie de plages horaires d’utilisation étendues (voir Horaires d’accès) et de tarifs adaptés (tarif autonome). Pendant les sessions réservées en autonomie (voir Réservation), les ingénieurs de la plateforme peuvent être sollicités pour des questions ponctuelles, ou en cas de problèmes techniques (dysfonctionnements ou défauts du matériel), aux horaires d’ouverture normale de la plateforme en fonction de leur disponibilité. En cas de besoin, l’utilisateur autonome peut réserver une session avec assistance (conseil, formation approfondie). L’utilisateur autonome est responsable de la qualité et de la gestion des résultats qu’il a obtenus. Un “cahier de suivi des séances”, situé à côté de chaque appareil, doit être rempli à chaque séance. Des documents (manuel d’utilisation, tutoriaux, …) sont mis à la disposition des utilisateurs et peuvent être consultés sur place. Pendant la prestation, l’utilisateur autonome est responsable du matériel mis à sa disposition. Il doit suivre les règles de mise en service, d’utilisation, de fermeture et de rangement des équipements et des réactifs utilisés. Le responsable d’équipe s’engage à payer la totalité des frais de réparation en cas de dommage lié à une mauvaise utilisation d’un équipement. Tout utilisateur autonome qui n’aurait pas utilisé un équipement depuis plus d’un an ou bien depuis la mise à jour d’un équipement (matériel, logiciel) devra suivre une formation complémentaire. Le statut d’utilisateur autonome est soumis à l’appréciation du personnel de la plateforme et peut être revu sans préavis. Un utilisateur autonome ne peut en aucun cas former un autre utilisateur.
2 – la session avec assistance
La session avec assistance est conduite en présence du personnel de la plateforme. Elle est proposée dans le cadre de la mise en œuvre de protocoles connus dans des conditions expérimentales standard, décidées avec l’utilisateur, et n’a pas de caractère inventif. Les ingénieurs de la plateforme impliqués se portent garants de la qualité des résultats, sous réserve que l’utilisation soit faite selon leurs recommandations, dans les conditions fixées en accord avec l’utilisateur. La session avec assistance fait l’objet d’une réservation préalable (voir Réservation), selon la disponibilité des équipements et des ingénieurs de la plateforme et uniquement pendant la plage horaire d’ouverture normale (voir Horaires d’accès). Elle fait l’objet de la tarification « assistée ».
3 – le projet collaboratif
Il s’agit du cas où le projet de l’utilisateur nécessite l’accompagnement d’un ou de plusieurs ingénieurs de la plateforme pour de l’assistance ponctuelle ou régulière ou pour le développement d’une technique ou d’une technologie pour les applications de l’utilisateur, ou d’un protocole d’acquisition ou de traitement des données. Les ingénieurs de la plateforme impliqués dans le projet se portent garants de la qualité des résultats obtenus et de leur restitution (échantillons, données). Les étapes d’un projet, peuvent être réalisées en présence ou en absence de l’utilisateur en fonction de ce qui a été décidé préalablement entre l’utilisateur et les ingénieurs impliqués. Dans le second cas elles ne font pas l’objet d’une réservation particulière. La facturation de projet peut être soumise à une tarification particulière, sur la base d’un devis, selon les équipements utilisés pour le projet. La facturation prendra en compte les heures réellement utilisées. Le tarif appliqué sera le tarif « utilisateurs assistés ».
L’utilisateur et son responsable s’engagent à signaler toute publication utilisant des résultats obtenus grâce à la plateforme et à se conformer aux prescriptions suivantes :
L’utilisateur et son responsable s’engagent à signaler toute publication utilisant des résultats obtenus grâce à la plateforme et à se conformer aux prescriptions suivantes :
“We acknowledge the ImagoSeine core facility of the Institut Jacques Monod, member of the France BioImaging infrastructure (https://ror.org/01y7vt929) supported by the French National Research Agency (ANR-24-INBS-0005 FBI BIOGEN) and GIS-IBiSA”
Il convient d’ajouter :
“and the support of La ligue contre le Cancer (R03/75-79)” pour les résultats obtenus avec le trieur FACSAria Fusion
“and the support of the Région Île-de-France (Sesame)” pour le SBF-SEM Teneo VS.
La marche à suivre
1) Contactez-nous par mail afin de fixer un rendez-vous avec notre équipe.
Cytométrie en flux contact
Microscopie électronique contact
Microscopie photonique contact
2) Lors de ce rendez-vous il est nécessaire que le responsable du projet soit présent et que vous nous fournissiez les informations importantes (but de l’expérience, type d’échantillons, marqueurs, support…).
Il sera décidé si votre projet nécessite une collaboration, une prestation ou une formation à l’un des appareils.
3) Inscrivez-vous sur le site de réservation de la plateforme.
Vous devez disposer d’une adresse mail professionnelle valide. Une fois vos informations validées par la plateforme, votre identifiant (prénom.nom) sera activé pour vous connecter.
4) Créez votre mot de passe de connexion au site de réservation sur cette page. Une fois connecté, téléchargez la charte, imprimez et signez la dernière page.
Coordinateur ImagoSeine
| René-Marc | MEGE | Platform coordinator | +33 (0)1 57 27 80 67 | contact |
| Jean-Marc | VERBAVATZ | Platform coordinator | +33 (0)1 57 27 80 04 | contact |
Cytométrie en flux
Microscopie électronique
Microscopie photonique
Responsable

Membres



Utilisation des équipements et prestations
Uniquement après réception de la charte signée, les prestations pouuront avoir lieu. Faites les demandes de formation des équipements et les demande de projet en collaboration une fois connecté sur le site de réservation dans l’onglet « Request ».
Charte à télécharger sur le site de réservation
Facturation
L’utilisation des équipements de la plateforme est payante (Voir nos tarifs ci-dessous). Les tarifs sont calculés de façon à couvrir l’entretien et la mise à jour des équipements de la plateforme.
Un relevé détaillé des prestations effectuées vous sera envoyée chaque mois. Vous devrez en retour envoyer un bon de commande au service comptabilité de l’institut.
Frais d’utilisation de la cytométrie en flux ImagoSeine
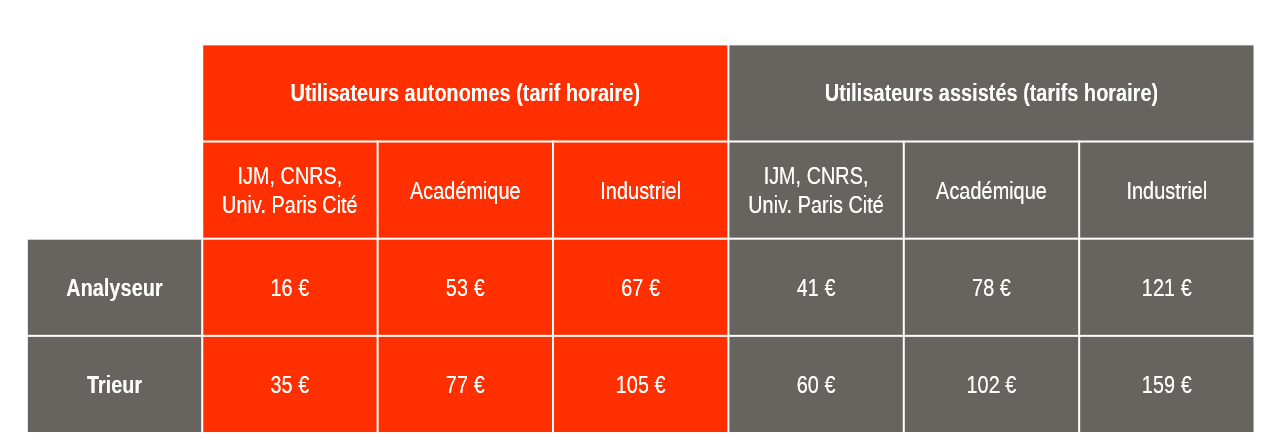
Frais d’utilisation de la microscopie photonique ImagoSeine

Pour les expériences longues, le prix est divisé par deux entre 20h et 9h et pendant le week-end.
Frais d’utilisation de la microscopie électronique ImagoSeine

Novembre 2024 : Nouveau cytomètre à ImagoSeine : l’Attune CytPix (ThermoFisher).
Ce cytomètre en flux, équipé de la technologie de focalisation acoustique, permet l’analyse d’événements rares. Sa caméra à haute vitesse capture des images en lumière blanche des cellules, associant des paramètres morphologiques aux données obtenues par cytométrie en flux conventionnelle. Cet équipement a été acquis avec le soutien de GIS IBiSA.
Juillet 2024 : Nouveau spinning Disk CSU W1 Nikon en pièce RH20B8.
Le spinning disk W1 Nikon dispose d’un champ plus grand que les spinning disk X1.
Une caméra très sensible ORCA-Fusion BT couplée à un incubateur et un autofocus PFS le rendent idéal pour l’observation des échantillons vivants.
Juillet 2024 : Ouverture d’un plein champ Leica DMI8 en pièce RH19B.
Le plein champ dispose d’un incubateur et d’un autofocus AFC pour l’observation des échantillons vivants. De nombreux objectifs sont disponibles.
Octobre 2022 : Nouveau confocal à balayage LSM980 Airyscan2 et module deux-photon disponible en pièce RH26B.
Confocal de dernière génération Zeiss, équipé pour les expériences en vivant, permettant la séparation spectrale simultanée ainsi que les expérience de FRAP. Le module Airyscan 4Y permet une augmentation de 50% de la résolution par rapport à un confocal classique et une augmentation de la vitesse d’acquisition. Le module de microscopie à deux photon permet l’observation plus en profondeur des échantillons.
Septembre 2022 : Nouveau système de microscopie en Super-Résolution ELYRA7 en pièce RH22B.
Microscope permettant les expérience de PALM et dSTORM pour une précision de localisation jusqu’à 20nm. Des expérience Lattice SIM permettant une augmentation de résolution 3D de deux fois par rapport à la limite théorique et compatible avec le vivant. Ainsi que le TIRF pour observer les évènements au niveau de l’interface membrane cellulaire et son substrat.
Juin 2022 : Nouveau module de FLIM et FCS Picoquant sur le confocal LSM980 en pièce RH20B1.
La technique de FLIM permet d’étudier la durée de vie de fluorescence dans l’échantillon ce qui renseigne sur son état biologique ainsi que les interaction entre protéines par la technique de FLIM-FRET. Les techniques de FCS permettent l’étude de la mobilité des molécules fluorescentes.
Septembre 2021 : Mise à jour du spinning Disk CSU X1 FRAP et Photoablation UV en pièce RH20B9.
Le spininng disk X1 FRAP dispose d’un nouveau banc laser (405nm, 445nm, 488nm, 561nm, 642nm) ainsi que la possibilité de faire du FRAP avec les 5 lasers et de la photo-ablation par UV pulsé.