Cytométrie en flux
La plateforme propose une expertise technique et des équipements de pointe pour l’analyse et le tri par cytométrie en flux.
Nos offres incluent le support pour la conception expérimentale, l’acquisition d’échantillons, l’analyse des données, ainsi que de fournir des services de tri cellulaire.
Principe :
La cytométrie en flux est une technique haut débit qui permet l’analyse multiparamétrique et quantitative à l’échelle de la cellule unique.
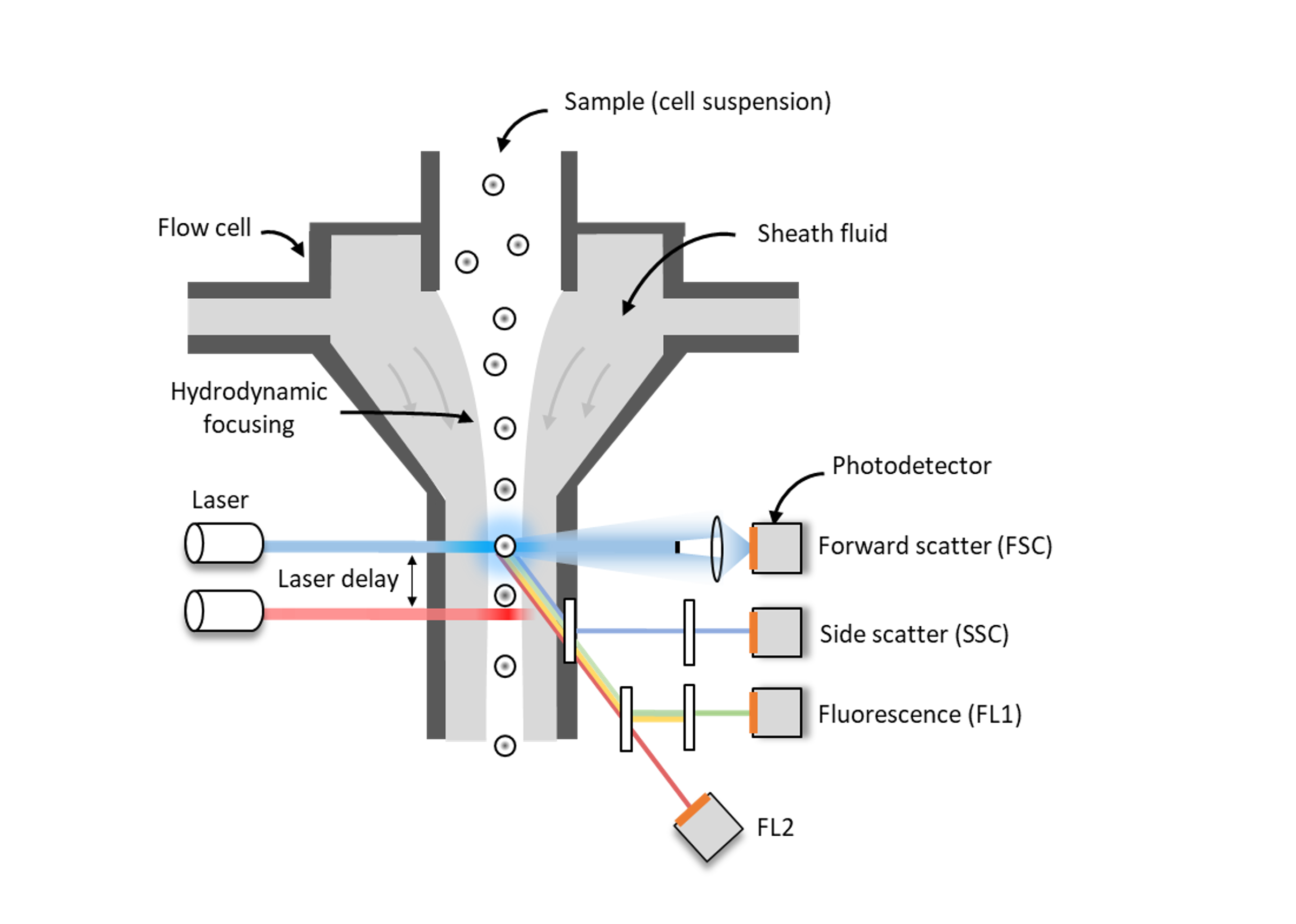
La suspension de cellules (ou d’éléments) est entrainée jusqu’à cuvette en quartz par un système de pression (ou pompe péristaltique). Les cellules sont alors centrées dans une veine liquide étroite grâce à un liquide de gaine (focalisation hydrodynamique). Les cellules (ou éléments) sont illuminées de manière séquentiel par un ou plusieurs faisceau(x) laser. Les signaux émis et d’intérêts (propriétés de diffusion, autofluorescence, fluorescence) sont collectés par des photodétecteurs (tube photomutiplicateur ou photodiode). Le signal lumineux est converti en un pulse électrique, puis en signal analogique.
Plusieurs signaux sont collectés :
- La lumière diffusée aux petits angles (Forward Scatter, FSC) qui renseigne sur la taille des particules,
- La lumière diffusée aux grands angles (Side Scatter, SSC) qui renseigne sur la structure interne de la cellule,
- L’émission de fluorescence
Expertises :
- Immunomarquage
- Phénotypage
- Cycle cellulaire, mesure de prolifération, taille de génome
- Viabilité, Apoptose
- Expression de protéine reportrice fluorescente (GFP, mCherry, mScarlet, senseur FRET…)
- Analyse fonctionnelle, flux métabolique
- Analyse de morphologie
- Analyse d’évènements rares
Nos équipements :
Analyseur : Attune CytPix (ThermoFisher)

Configuration optique :
- Bleu : 488nm (3 paramètres)
- Rouge : 640nm (3 paramètres)
- Violet : 405nm (4 paramètres)
- YG : 561nm (4 paramètres)
Camera pour observation en lumière blanche
Trieur : FACSAria Fusion (BD)

BSL2
Buses : 70µm ; 85µm ; 100µm ; 130 µm
1-4 voies de tri : Tubes 1,5 mL ; 2mL ; 5mL ; 15mL ; plaques 6, 12, 24, 48, 96, 384 puits ; lames ; custom
Configuration optique :
- Bleu : 488nm (4 paramètres)
- Rouge : 633nm (3 paramètres)
- Violet : 405nm (4 paramètres)
- YG : 561nm (4 paramètres)
- UV : 355nm (3 paramètres)
Analyse de données
Différents logiciels d’analyse sont disponibles : FlowJo, Diva, FCS Express, Attune software.

