Marianne Malartre
Thèse – 2000-2004
- Université de Portsmouth, Angleterre. Equipe « Retinoic Acid Signaling and Primary Neuron Development» (Colin Sharpe).
- Projet: Le role des co-répresseurs aux récepteurs nucléaires dans la neurogenèse primaire du xénope.
Post-doctorat – 2004-2009
- Centre Andalou de Biologie du Développement (CABD), Séville, Espagne.
- Equipe « Genetic and Cellular Mechanisms Regulating Cell Migration and Invasion » (Lola Martin-Bermudo)
- Projet: Le rôle de l’oncogène vav dans le développement du système nerveux de la drosophile.
Maître de conférences, Université Paris-Saclay – 2009-2024
- 2009-2013 : INSERM UMR-S 757, équipe « Signalisation Calcique et Régénération Hépatique » (Laurent Combettes).
- Projet : Signalisation calcique pendant la régénération cellulaire chez la drosophile
- 2013-2024 : I2BC (Institut de Biologie Intégrative de Cellule), équipe « Signalisation Cellulaire et Morphogenèse » (Anne-Marie Pret).
- Projet : Rôle et régulation de la voie de signalisation JAK/STAT au cours de l’ovogenèse de la drosophile.
Professeur, Université Paris Cité – depuis 2024
- UMR7592, Institut Jacques Monod, équipe « Comparative developmental neurobiology laboratory » (Nikos Konstantinides).
- Projet : Arrêt du renouvellement des cellules souches neurales au cours de la neurogenèse du lobe optique de la drosophile
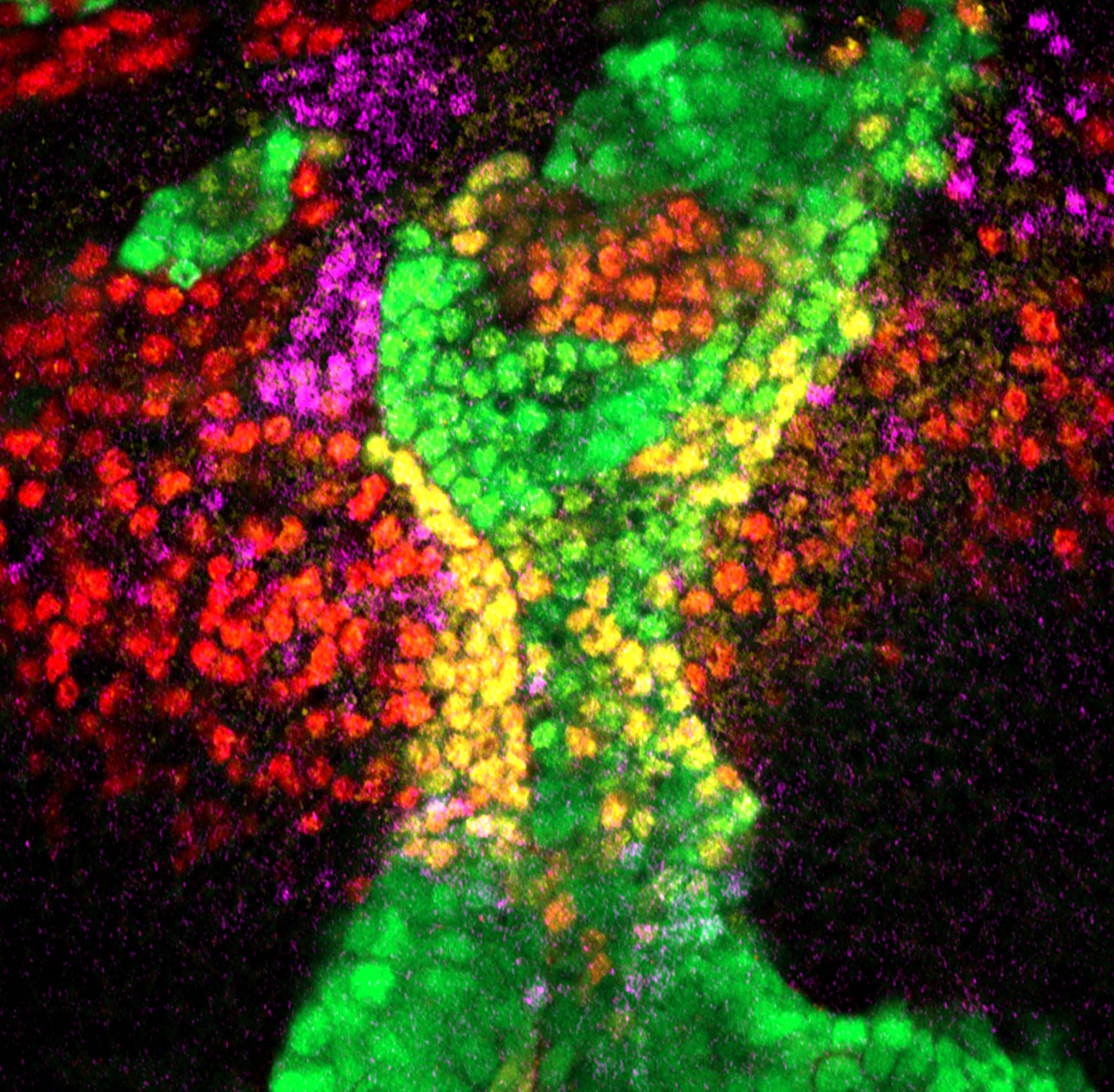
- L’arrêt contrôlé des cellules souches neurales est essentiel au développement du cerveau ainsi que pour prévenir une prolifération excessive qui pourrait devenir tumorale. Chez la drosophile, les cellules souches neurales suivent un programme temporel précis d’expression de facteurs de transcription qui génèrent la diversité neurale. Toute perturbation de ce programme peut prolonger l’état souche de ces progéniteurs, retardant leur élimination et pouvant déclencher une sur-prolifération. Nous cherchons à disséquer la manière dont les neuroblastes assurent une fin robuste de l’état souche. Nous exploitons en particulier une région du lobe optique, le tOPC, un système relativement simple dans lequel nous avons montré que les cellules souches neurales pouvaient emprunter un programme temporel soit long, soit tronqué. Nous cherchons actuellement à identifier quels mécanismes moléculaires sont à l’œuvre pour faire varier la fin de l’état souches de ces progéniteurs neuraux, ce qui a des conséquences, in fine, sur la diversité neurale. A l’aide des outils génétiques puissants de la drosophile, nous souhaitons déterminer comment ces lignages se terminent de différentes manières et quelles sont les conséquences d’un défaut de fin de l’état souche.
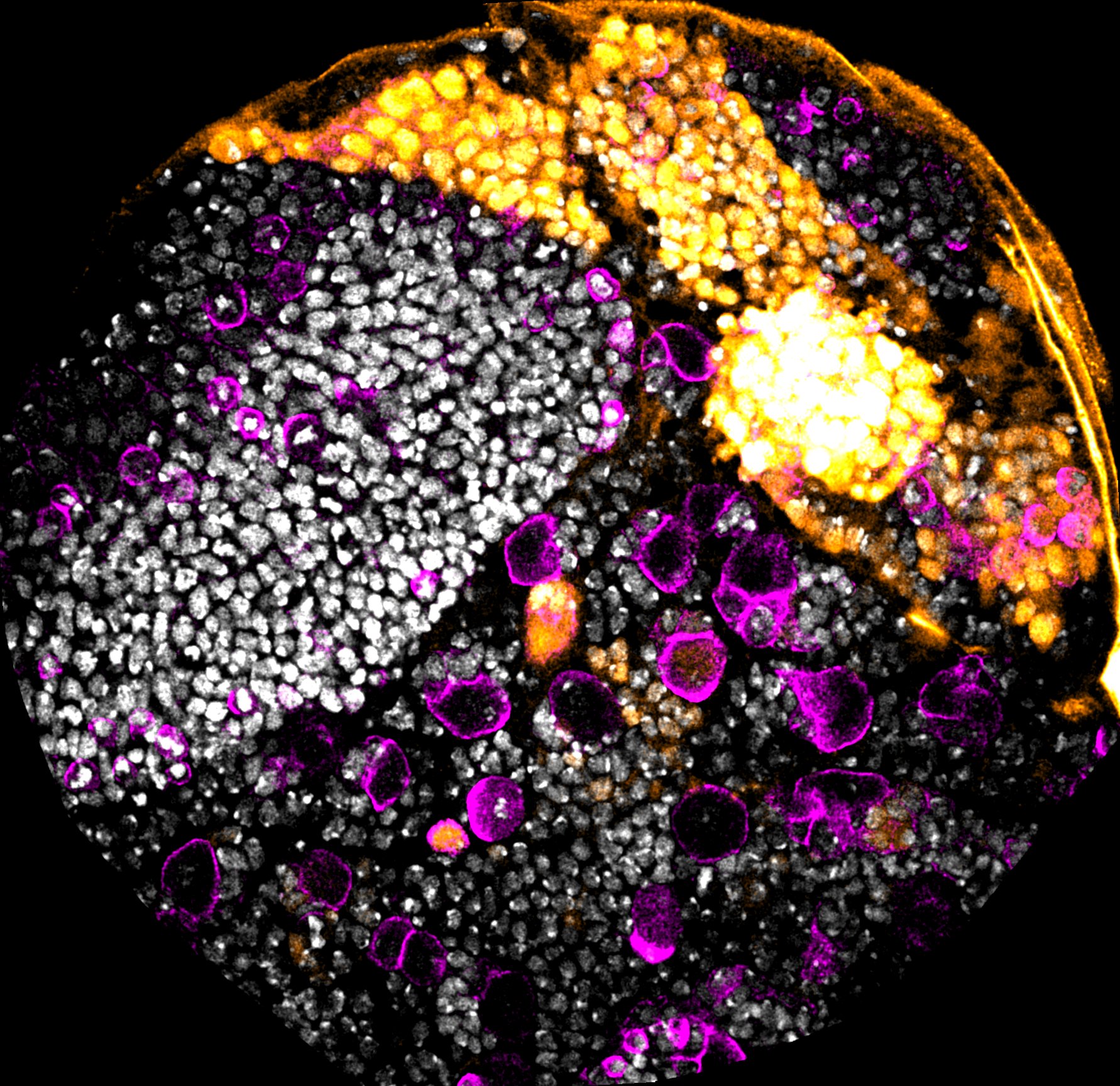
- Dans une autre partie du projet, nous nous intéressons au rôle de l’environnement sur ces mêmes séries temporelles qui assurent la diversité neurale. Nous souhaiterions savoir si des conditions environnementales telles que des changements de température ou de nutrition au cours du développement peuvent avoir des conséquences sur la diversité neurale ou si des mécanismes sont mis en place pour protéger le développement de ces cellules afin de pouvoir générer tous les types de neurones de manière robuste.
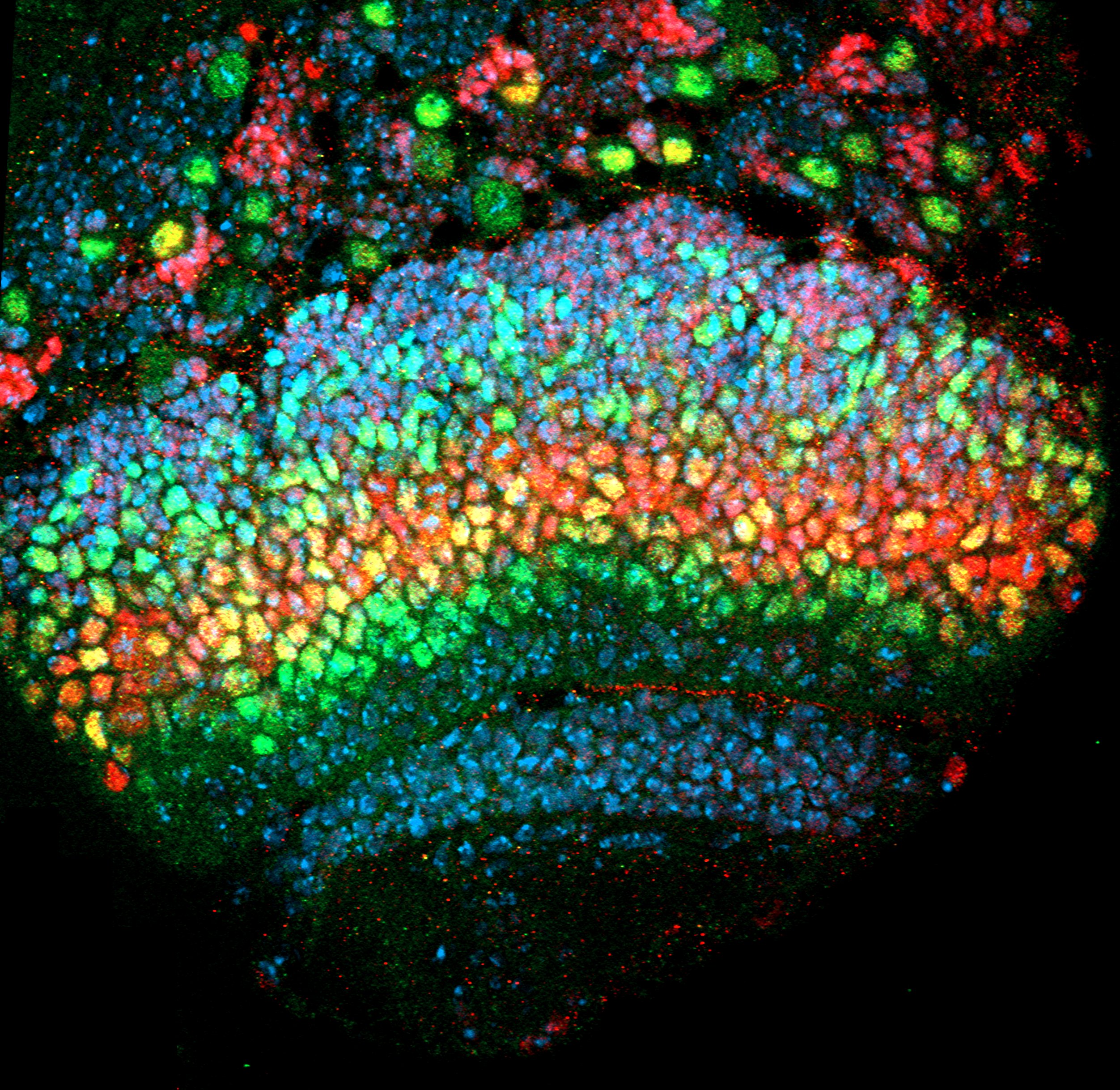
2018-2019 (2 ans) : La Ligue contre le Cancer (40k€). JAK-STAT signaling and epithelial integrity.
Thèses
- Marie-Charlotte Devagourou – 2025-2028 – Neural stem cell termination in the developing Drosophila brain.
- Kyriaki Niovi Rafailidou (co-encadrement Nikos Konstantinides) – 2025-2028 – Exploring the complete neurogenic potential of a brain structure
- Charlotte Mallart – 2018-2022 – Régulation et cibles de la voie JAK-STAT au cours de l’ovogenèse chez la drosophile.
- Laurine Miscopein-Saler (co-encadrement Anne-Marie Pret) – 2015-2016 – Rôle du locus bric-à-brac durant la formation des niches de cellules souches germinales dans l’ovaire chez Drosophila Melanogaster.
- Alba Torres (co-encadrement Francois Agnès et Anne-Marie Pret) – 2013-2016 – Lien entre signalisation JAK/STAT, remodelage cellulaire et extrusion d’un groupe de cellules épithéliales dans l’ovaire de drosophile.
18 étudiants de Licence et Master – 2010-2025
- 8 étudiants de L2 ; 2 étudiants Erasmus (Porstmouth) ; 2 étudiantes de L3 ; 3 étudiants de M1 ; 3 étudiants de M2.
Paris-Saclay – 2009-2024
- Enseignements à tous les niveaux de la L1 au M2 dans diverses UE de biologie du développement, génétique, biologie cellulaire et anglais scientifique.
Paris Cité – Depuis 2024
- L2 : Génétique (TD, TP) ; Biologie Evolutive (TD, TP) ; Mécanismes du développement (CM, TD)
- L3 Biodiversité et Ecosystèmes: Interface Ecologie, Evolution et Développement (CM)
- L3 Biosciences : Biologie du développement, outils et concepts (CM, TD, TP)
- L3 Magistère Européen de Génétique : Biologie du développement animal (CM, TD)
- M1 Neurosciences : Neurodéveloppement et évolution (CM, TD)
- M1 Magistère Européen de Génétique : Génétique du développement et biologie cellulaire (CM, TD)
- M1 BMC : Biologie moléculaire du développement (CM, TD)
- M2 GDC : Articles en anglais, jurys de soutenance
- M2 Magistère Européen de Génétique : Plasticité et évolution du développement (CM, TD)
https://orcid.org/0000-0003-2616-6976
Sélection de publications.
* corresponding author
2024 Mallart C., Netter S., Chalvet F., Montagne J., Claret S., Guichet A., Pret AM. and Malartre M.*. JAK-STAT-dependent contact between follicle cells and the oocyte controls Drosophila anterior-posterior polarity and germline development. Nat. Commun. 15, 1627.
Newsletters:
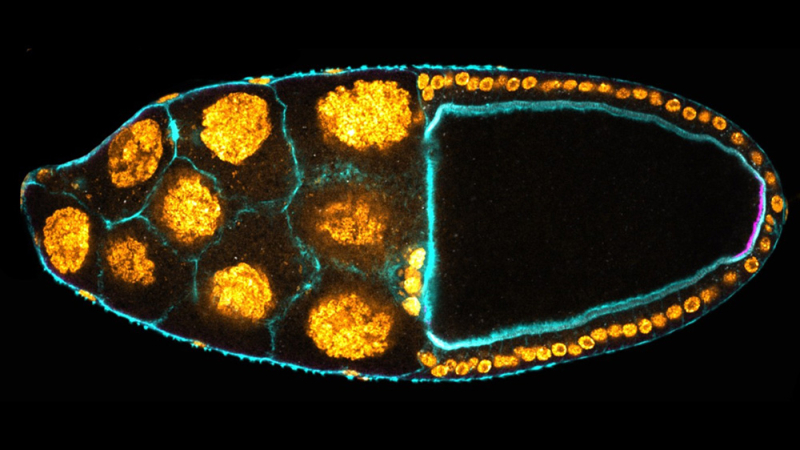
2022 Mallart C., Chalvet F., Sophie Netter, Torres A., Pret AM. and Malartre M.*. E-Cadherin acts as a positive regulator of the JAK-STAT signaling pathway during Drosophila oogenesis. Front. Cell Dev. Biol.. Aug 23;10:886312.
2020 Miscopein Saler L., Hauser V., Bartoletti M., Mallart C., Malartre M, Lebrun L., Pret AM Theodore L., Chalvet F. and Netter S. The Bric-à-Brac BTB/POZ transcription factors are necessary in niche cells for germline stem cells establishment and homeostasis through control of BMP/DPP signaling in the Drosophila melanogaster ovary. PLoS Genet. Nov 5;16(11):e1009128
2017 Yurani Torres A, Malartre M, Pret AM and Agnès F. JAK/STAT signaling is necessary for cell monosis prior to epithelial cell apoptotic extrusion. Cell Death Dis. May 25;8(5):e2814.
2016 Malartre M*. Regulatory mechanisms of EGFR signalling during Drosophila eye Development. Cell. Mol. Life Sci. 73:1825–1843.
Revue invitée.
2015 Martı́n-Bermudo MD, Bardet PL, Bellaïche Y, and Malartre M*. The vav oncogene antagonises EGFR signalling and regulates adherens junction dynamics during Drosophila eye development. Development. 142, 1-10.
- Sélectionné pour la couverture du journal.
- “Comment” dans Articles of Interest de J. Cell Science.
- Sélectionné comme Biomedical Picture of the Day (BPoD).

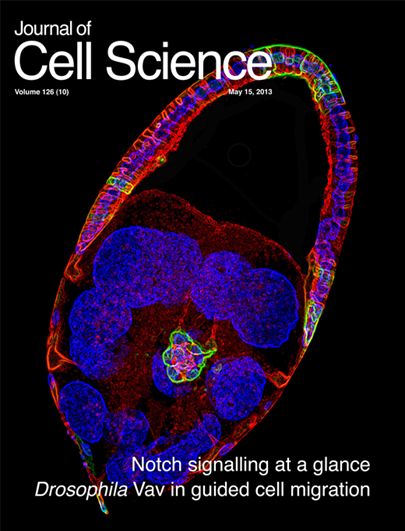
2013 Fernandez-Espartero C, Ramel D†, Farago M†, Malartre M†, Luque C†, Limanovich S, Katzav S, Emery G, and Martın-Bermudo MD. GTP exchange factor Vav regulates guided cell migration by coupling guidance receptor signalling to local Rac activation. J Cell Science. 126(10):2285-93
- Sélectionné pour la couverture du journal.
2010 Malartre M, Ayaz D, Amador FF, Martín-Bermudo MD. The guanine exchange factor vav controls axon growth and guidance during Drosophila development. J Neurosci. 30(6):2257-67.
- Featured article. « This week in the Journal: Role of vav in axon guidance ».

