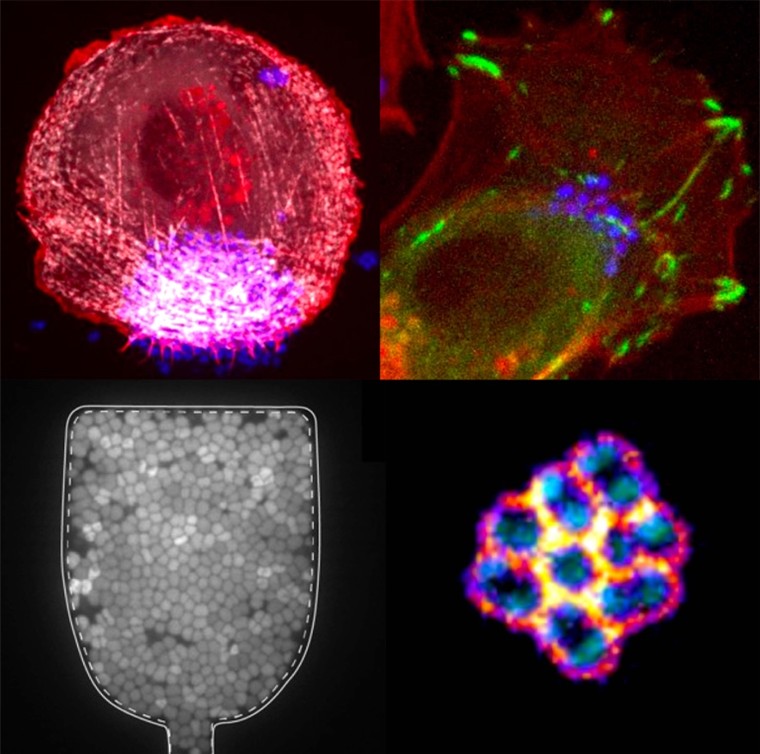
Biologie Quantitative de l’Infection Bactérienne
Daria BONAZZI
Les bactéries pathogènes peuvent traverser les barrières tissulaires pour envahir l’hôte et s’y disséminer. Bien que de nombreux mécanismes moléculaires impliqués dans ces étapes clés de l’infection aient été identifiés, les forces physiques en jeu — ainsi que leurs effets sur les cellules infectées, la matrice extracellulaire et les cellules voisines — restent encore mal comprises.
Dans notre laboratoire, nous étudions ces forces et analysons leur influence à la fois sur la physiologie bactérienne et sur la mécanique des tissus. Nos travaux portent principalement sur Neisseria meningitidis, une bactérie extracellulaire spécifique de l’humain, responsable de maladies graves telles que le choc septique et la méningite. Cet organisme constitue un excellent modèle pour nos recherches, car les méningocoques utilisent des pili de Type IV pour interagir avec leur environnement et avec les tissus de l’hôte, générant de fortes forces de traction capables de moduler la contractilité des cellules hôtes.
Pour répondre à ces questions, nous combinons imagerie en direct, microfabrication, microfluidique et approches génétiques dans des modèles cellulaires et tissulaires in vitro d’infection. Nos recherches visent à comprendre comment la mécanique tissulaire et la fonction des barrières sont modifiées lorsque les méningocoques manipulent mécaniquement les tissus de l’hôte afin de favoriser leur dissémination et d’induire des dommages vasculaires.
Mots clés : mécanobiologie, infection, Neisseria meningitidis, pili de Type-IV, interaction hôte/pathogène, barrière tissulaire, mécanique cellulaire, mécanotransduction, physiologie bactérienne, microscopie, microfabrication, microfluidique, lésions vasculaires.
Introduction
Forces à l’interface hôte/pathogène
Les cellules des mammifères perçoivent et génèrent en permanence des forces mécaniques dans leur microenvironnement pour maintenir leur fonction, même lors de déformations ou de processus dynamiques tels que la migration, la division et la mort cellulaire. Cette résilience mécanique est particulièrement importante pour les barrières épithéliales et endothéliales, qui doivent préserver leur intégrité face aux pathogènes.
Bien que la mécanobiologie ait révélé des principes clés de la mécanique des tissus et des microbes, il reste encore incertain comment les signaux mécaniques sont intégrés à différentes échelles pour maintenir l’homéostasie tissulaire lors des infections bactériennes. Des études récentes montrent que les pathogènes peuvent perturber mécaniquement les tissus, influençant le déroulement de l’infection et donnant naissance à un nouveau champ de recherche : la « mécanobiologie de l’infection ». Ce domaine interdisciplinaire, à la croisée de la microbiologie, de la biologie cellulaire et de la physique, vise désormais à répondre à des questions clés : quelles forces s’exercent à l’interface entre les pathogènes extracellulaires et l’hôte ? Et comment ces forces s’articulent-elles avec les interactions bactéries–bactéries au sein d’une colonie ?
Infection à méningocoques : le rôle de la mécanique tissulaire dans la fonction de barrière
Neisseria meningitidis (Nm) constitue un excellent modèle pour étudier la mécanique des interactions hôte–pathogène, car lors de l’infection, ses colonies multicellulaires rencontrent plusieurs barrières tissulaires, chacune présentant des propriétés mécaniques distinctes. Normalement commensale de l’épithélium nasopharyngé, Nm peut provoquer des maladies graves telles que la septicémie et la méningite lorsqu’elle pénètre dans la circulation sanguine et franchit la barrière hémato-encéphalique. Tout au long de son cycle infectieux, Nm est soumis à différentes forces mécaniques, notamment l’adhésion aux cellules épithéliales ou endothéliales, les forces générées par la croissance et l’agrégation bactériennes, la résistance à l’écoulement des fluides, ainsi que les forces impliquées dans la fuite vasculaire et la dissémination.
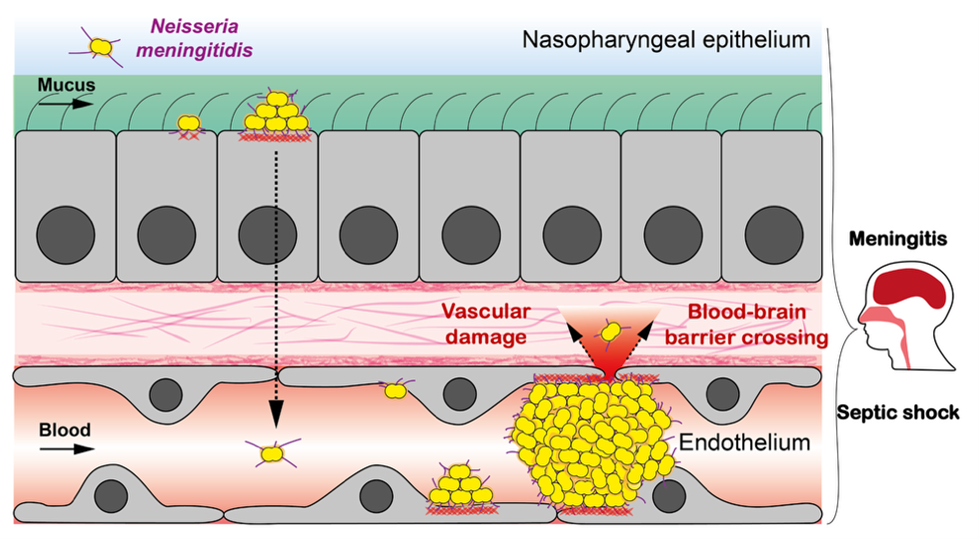
Schematics of Nm infection cycle. We aim at studying the potential interplay of mechanical forces in barrier breaching of epithelia and endothelia.
Ces processus dépendent des pili de type-IV (T4P), des appendices rétractiles puissants. Des travaux antérieurs ont montré que la dynamique des T4P génère des interactions intermittentes entre bactéries, permettant la formation d’agrégats cohésifs et fluides qui s’adaptent à la géométrie des vaisseaux sanguins (Bonazzi et al., Cell, 2018). Nm induit également l’étalement de la membrane dans la cellule hôte, guidé par l’adhésion le long des fibres T4P (« 1D-wetting ») (Charles-Orszag et al., Nat Commun, 2018), et déclenche l’assemblage d’une plaque corticale riche en actine, qui stabilise les colonies sous flux mais affaiblit les jonctions cellule–cellule, favorisant ainsi les dommages vasculaires.
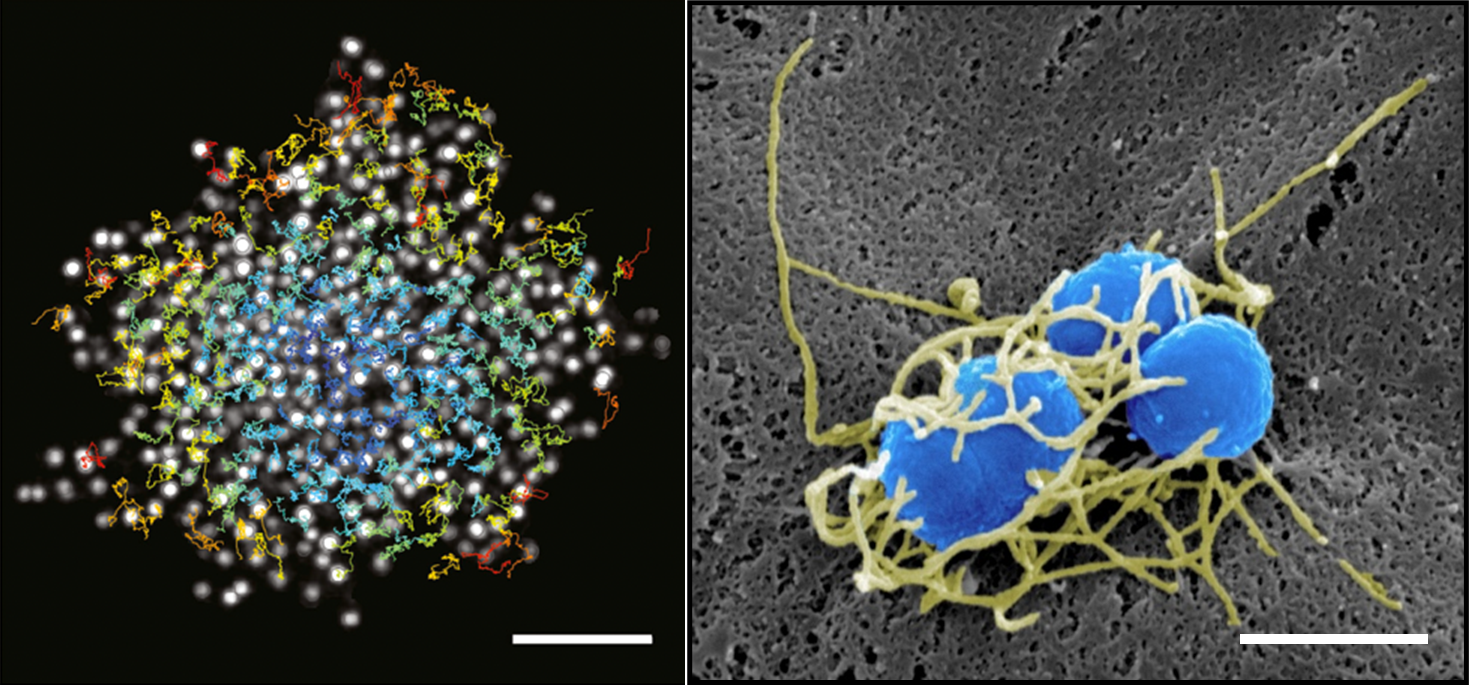
On the left, single confocal slice of a WT iRFP meningococcal aggregate in the middle plane and overlay of single bacterial tracks (color-coded by their mean instantaneous speeds). Scale bar, 10 μm. From Bonazzi et al, Cell, 2018. On the right, SEM image of a small bacterial colony, featuring a dense meshwork of Type-IV pili (false colored in yellow) that encloses the bacterial bodies (false colored in blue). Scale bar, 1 μm. From Charles-Orszag et al, Nat comm, 2018
Projets actuels
Contrôle de la mécanique de l’hôte par un pathogène bactérien et impact fonctionnel
Des travaux récents de l’équipe ont montré que l’adhésion de Neisseria meningitidis (Nm) déclenche de fortes forces de traction localisées dans les cellules endothéliales, coordonnées par le site d’attachement bactérien à la surface apicale jusqu’au substrat basal. Cette communication mécanique apico–basale implique une nouvelle structure riche en actine, appelée ancreopodia (Sankara et al., en préparation).
Nous étudions maintenant comment l’adhésion extracellulaire de Nm modifie la mécanique et la fonction de l’hôte, de l’échelle subcellulaire à l’échelle tissulaire. Cela inclut les forces directement exercées par les bactéries — comme l’adhésion et la traction médiées par les pili de type IV (T4P) — ainsi que la reprogrammation cellulaire et les modifications cytosquelettiques qui perturbent indirectement les forces intercellulaires.
Le projet vise à :
- Identifier les principaux acteurs moléculaires impliqués dans le remodelage des cellules hôtes lors de l’infection par Nm et étudier leur dynamique.
- Mesurer les changements mécaniques dans les tissus infectés à l’aide d’outils biophysiques (traction force microscopy, sondes FRET de tension, micropatterning, essais de flux) et d’approches théoriques.
- Déterminer comment l’infection affecte le comportement cellulaire, l’architecture tissulaire et l’intégrité des barrières.
En considérant bactéries et cellules hôtes comme des systèmes actifs générant des forces, nous cherchons à comprendre comment l’adhésion bactérienne modifie la mécanique, la polarité et la motilité des cellules, et comment le remodelage cytosquelettique perturbe la tension corticale et l’organisation intracellulaire, affaiblissant les barrières tissulaires.
Réponse bactérienne au confinement mécanique
Dans les agrégats multicellulaires, la prolifération bactérienne se fait dans un espace limité, générant des contraintes mécaniques internes. Cela peut se produire dans les biofilms en croissance, mais aussi lors de l’infection, lorsque les bactéries se développent dans des compartiments intracellulaires ou des niches tissulaires.
Pour étudier ces forces générées par la prolifération bactérienne dans un espace limité, nous avons développé une puce microfluidique en PDMS permettant le contrôle de l’environnement mécanique et chimique (collaboration avec M. Delarue, LAAS CNRS et G. Dumenil, Institut Pasteur). Ce dispositif limite l’évasion bactérienne via des canaux submicroniques, facilite le renouvellement du milieu et permet de mesurer directement la pression induite par la croissance bactérienne. Nous avons montré que le confinement d’Escherichia coli génère des forces de compression très élevées (centaines de kPa), entraînant des changements importants dans la forme cellulaire, la croissance, la division, les propriétés cytoplasmiques et l’expression génétique. Cette réponse est conservée chez une souche pathogène d’E. coli responsable d’infections urinaires, suggérant que le stress mécanique induit par la contrainte peut contribuer à la progression de la maladie, comme le confirment des expériences in vivo et ex vivo (collaboration avec M. Ingersoll, Institut Cochin).
Nous étudions désormais les mécanismes moléculaires à l’origine de la reprogrammation transcriptionnelle des bactéries sous contrainte mécanique, en analysant la dynamique spatio-temporelle au niveau de la cellule unique. Pour cela, nous développons des techniques de criblage à grande échelle combinées à une nouvelle génération de puces microfluidiques permettant de confiner un grand nombre de bactéries et de les récupérer ensuite. Parallèlement, nous avons créé une petite bibliothèque des rapporteurs fluorescents des voies de stress pour caractériser la distribution spatiale de l’activation transcriptionnelle dans la chambre et la combiner à des mesures de distribution de stress grâce à des capteurs locaux de pression.
Enfin, nous souhaitons étendre ces études à d’autres espèces bactériennes (notamment Nm, qui pourrait rencontrer des contraintes mécaniques aux stades avancés de la colonisation vasculaire) et évaluer si l’adaptation à la contrainte contribue à l’émergence de la tolérance aux antibiotiques.
Morphogenèse et croissance d’un diplocoque
Les bactéries contrôlent rigoureusement leur taille et leur forme au cours du cycle cellulaire. Pour les bactéries en forme de bâtonnet comme E. coli, l’imagerie à haut débit combinée à l’analyse d’images permet une vue intégrée du cycle cellulaire et de sa régulation. Cependant, pour les diplocoques — bactéries formées de deux cellules rondes jointes — la régulation de la taille, de la forme et de la division reste mal comprise.
Dans l’équipe, nous visons à caractériser quantitativement le cycle cellulaire de Nm en développant un pipeline d’analyse d’images performant pour le suivi automatisé des cellules et l’analyse de lignées. Nous étudions la dynamique des composants cellulaires de Nm et l’impact des contraintes chimiques et mécaniques sur cette dynamique, au niveau individuel et sur plusieurs générations. Deux défis principaux sont abordés : mesurer avec précision les changements subtils de forme de ces petites bactéries lors de leur division et intégrer ces mesures individuelles dans des lignées couvrant plusieurs cycles de division.
Ce travail permettra de déployer des outils d’analyse utiles à la communauté de la biologie cellulaire quantitative, d’identifier les mécanismes d’adaptation cellulaire assurant la survie pendant l’infection, et potentiellement d’utiliser le contrôle de la forme cellulaire comme nouvelle cible pour le traitement des maladies.
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
Laura Xénard (co-encadrement avec G. Dumenil et J.Y. Tinevez, Institut Pasteur)
Morgan Delarue (LAAS CNRS, Toulouse),
Guillaume Dumenil (institut Pasteur, Paris)
- ERC Starting