Hugo Wioland
Depuis 2020 : Chargé de Recherche au CNRS section 22
Institut Jacques Monod, CNRS, Université Paris Cité, France. équipe Régulation de la Dynamique du Cytosquelette (G. Romet-Lemonne & A. Jégou)
Rôle des tropomyosines dans la différentiation des réseaux de filaments d’actine.
2015 – 2020 : Post-doctorant
Institut Jacques Monod, CNRS, Université Paris Cité, France. équipe Régulation de la Dynamique d’Assemblage de l’Actine (G. Romet-Lemonne & A. Jégou)
Régulation du désassemblage des filaments d’actine par des facteurs biochimiques et biomécaniques.
2011-2015 : Thèse
DAMTP, University of Cambridge, United-Kingdom. Raymond E. Goldstein lab
Thèse “Self-Organization of Confined Active Matter”
Étude des mouvements collectifs de bactéries au sein de nouvelles micro chambres.
Mon projet scientifique à long terme vise à comprendre comment divers réseaux de filaments d’actine peuvent émerger et coexister au sein d’une même cellule. Je m’intéresse particulièrement aux nombreux facteurs qui rendent chaque filament d’actine unique, bien qu’assemblés à partir du même réservoirs de monomères d’actine :
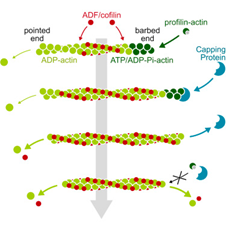
- Régulation mécanique : j’ai mis en place plusieurs dispositifs expérimentaux afin d’appliquer tension, torsion et courbure à des filaments d’actine individuels, et j’ai montré, par exemple, que la protéine de liaison à l’actine ADF/cofiline exerce une torsion qui favorise la fragmentation des filaments. Je cherche actuellement à comprendre comment les contraintes mécaniques individuelles et combinées peuvent réguler la liaison des protéines aux filaments.
- Modifications post-traductionnelles de l’actine: bien que de nombreuses modifications post-traductionnelles (PTM) peuvent affecter les monomères d’actine, leur impact sur la dynamique des filaments a été très peu étudié. J’ai étudié de manière approfondie l’oxydation de l’actine Met44 et Met47 par l’oxydoréductase MICAL1 et je vise désormais à identifier et à caractériser d’autres modifications.
- Tropomyosines: en recouvrant plus de 80 % des filaments dans les cellules, les tropomyosines régulent l’activité de nombreuses autres protéines du cytosquelette et définissent ainsi l’identité des filaments. Je m’intéresse particulièrement aux facteurs qui déterminent quelle isoforme de tropomyosine recouvrira l’actine.
Afin de mieux étudier les propriétés biochimiques et biomécaniques des filaments d’actine, nous réalisons des expériences in vitro avec des protéines purifiées et marquées en fluorescence. Des centaines de filaments d’actine individuels sont reconstitués à l’intérieur d’une chambre microfluidique et exposés à des solutions contenant les protéines d’intérêt. Cela nous permet de quantifier avec précision la dynamique des filaments d’actine et de leurs partenaires, et de caractériser les interactions moléculaires qui façonnent les réseaux de filaments à l’intérieur des cellules.

Jan. 2026 – Déc 2029 | ANR PRC | 188 800 €
Partenaire du projet MyoAssemble (montant total : 676 960 €), dirigé par Anne Houdusse à l’Institut Curie. Notre objectif est de caractériser un moteur la myosine 18, dépourvue d’activité ATPase, à l’aide d’approches structurelles et biophysiques.
Juin 2022 | Maupertius Short Mobility program | 1200 €
Avec le soutien de l’Institut Français en Finlande, j’ai eu l’occasion de visiter le laboratoire de Pekka Lappalainen (Université d’Helsinki) afin d’établir une collaboration sur l’étude des tropomyosines.
Jan. 2022 – Déc. 2025 | ANR JCJC | 320 000 €
Tropomyosines et différenciation des réseaux de filaments d’actine.
March 2015 – Feb. 2018 Bourse de post-doctorat | Fondation ARC | Trois ans de salaire
- Anne Houdusse, Institut Curie | Financement : ANR PRC MyoAssemble
Nouvelle collaboration sur la myosin 18.
- Pekka Lappalainen, University of Helsinki | Financement : Maupertius Short Mobility
Collaboration de longue date sur diverses protéines de liaison à l’actine.
- Arnaud Echard et Stéphane Frémont, Institut Pasteur
Collaboration de longue date sur l’oxydation de l’actine par l’enzyme MICAL.
- Morgan Chabanon, CentraleSupélec
Collaboration récente afin d’analyser nos expériences à l’aide de simulations numériques.
Ingénieur – Jean-Baptiste Berthelot | depuis 2025, ANR MyoAssemble – production et purification de protéines
Post-doctorante – Dina Al Abiad | 2023-2025, ANR TropActin – Régulation biochimique du recrutement des tropomyosines par la tropomoduline et les modifications post-traductionnelles de l’actine.
Etudiante en thèse – Camille Bagès | 2022-2026, ANR TropActin – Régulation mécanique du recrutement des tropomyosines et des protéines à domaine LIM.
Stagiaires – 5 étudiant·e·s en master et 4 en licence.
Sélections de publications
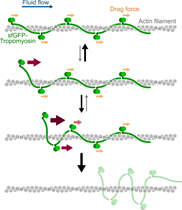
- Probing protein–protein interactions with drag flow: a case study of F-actin and tropomyosin, Bagès et al., European Journal of Physics E, 2025
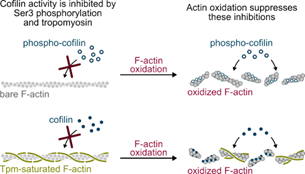
- Actin filament oxidation by MICAL1 suppresses protections from cofilin-induced disassembly, Wioland et al., EMBO Reports, 2021
- Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing, Wioland et al., PNAS, 2019
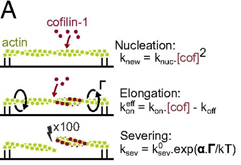
- ADF/cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends, Wioland et al., Current Biology, 2017
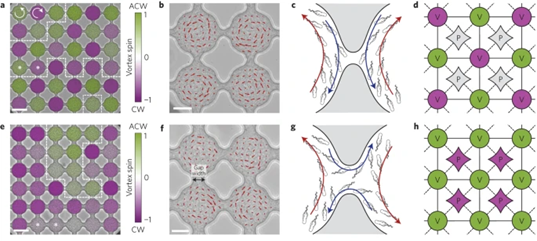
- Ferromagnetic and antiferromagnetic order in bacterial vortex lattices, Wioland et al., Nature Physics, 2016