Véronique Brodu
Dynamique et fonction du cytosquelette dans la migration collective lors de la morphogenèse du système trachéal de l’embryon de Drosophile.
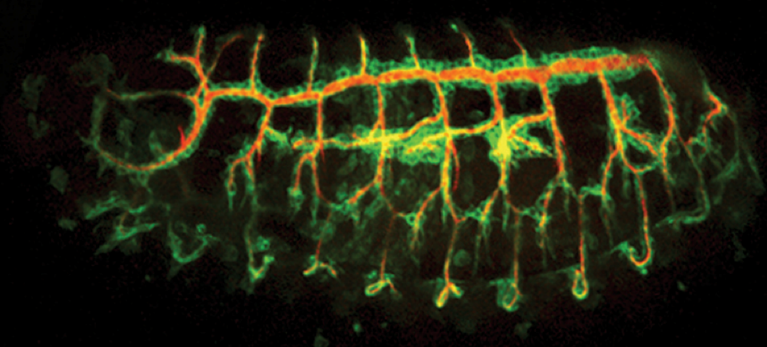
Organisation du système trachéal (cellules en vert et lumière en rouge) dans l’embryon de Drosophile
- 1996-2000
Thèse de Doctorat Spécialité Physiologie des Invertébrés, Université Paris VI. Thèse réalisée dans l’équipe de Jean-Antoine LEPESANT (Institut Jacques Monod, Paris, CNRS UMR 7592) sous la direction de Christophe ANTONIEWSKI
- 2000- 2003
Formation Post-doctorale, Laboratoire du Dr Alex GOULD, National Institute for Medical Research, MRC, Londres, Royaume Uni
- 2003- 2006
Formation Post-doctorale, Laboratoire du Pr. Jordi CASANOVA, Institut de Biologia Molecular de Barcelona (IBMB), CSIC, Parc Cientific de Barcelona, IRBB, Barcelone, Espagne
- 2006- présent
Chargée de Recherche 1ère classe au CNRS, Equipe « Polarité et Morphogenèse » dirigée par Antoine GUICHET, Institut Jacques Monod, Paris, CNRS UMR 7592
Au cours du développement, les tissus se réorganisent pour former les organes, notamment grâce à la migration collective des cellules. Certains cancers exploitent d’ailleurs ces mêmes mécanismes pour envahir de nouveaux tissus. Lors de l’organogenèse, le remodelage épithélial repose sur des changements de forme et de position des cellules tout en maintenant leurs contacts. Les modèles in vitro ont permis d’identifier les principes de base de la motilité cellulaire, aujourd’hui complétés par des études 3D montrant comment la morphogenèse résulte de l’interaction entre l’actomyosine, génératrice de force, et les complexes d’adhésion qui stabilisent tissus et cellules.
Les jonctions d’adhérence (AJ) assurent la cohésion cellulaire tout en devant se réorganiser activement pour accompagner la morphogenèse. Un composant essentiel des AJs est la protéine transmembranaire E-Cadherin (E-Cad), établissant des interactions homophiliques via son domaine extracellulaire. Son domaine intracellulaire est associé aux réseaux d’actomyosine et de microtubules, deux réseaux dynamiques indispensables à la migration, à la déformation et à l’adhésion cellulaires, ainsi qu’à la résistance mécanique des contacts.
Afin de découvrir les processus fondamentaux essentiels au remodelage cellulaire lors de l’organogenèse in vivo, nous étudions la formation du système respiratoire, ou système trachéal, dans l’embryon de drosophile. Le système trachéal est constitué de structures tubulaires branchées dont les cellules s’organisent autour d’une lumière. La formation de ce réseau tubulaire est hautement stéréotypée et dépend en partie de la capacité des cellules à migrer de façon collective en réponse à la chémo-attraction exercée par la localisation du ligand de la voie FGF. Il est important de noter que les réarrangements cellulaires maintiennent en permanence les contacts entre cellules trachéales et qu’ils ne dépendent pas de l’activité contractile de la Myosine II. Le système trachéal offre donc la possibilité de caractériser de nouveaux mécanismes d’intercalation cellulaire pour lesquels la fonction de myosine II n’est pas requise.
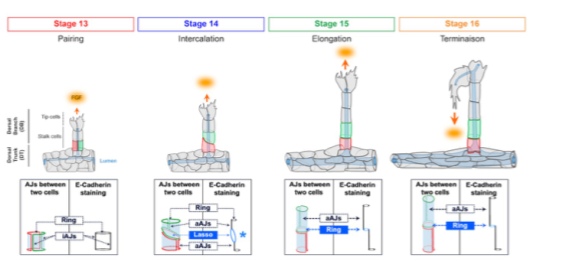
Etapes d’intercalation 3D accompagnant la morphogenèse de la branche dorsale
Dynamique fonctionnelle de l’organisation du réseau de microtubules au cours de la migration collective des cellules trachéales
La réalisation de ce projet a permis de caractériser l’organisation et la nucléation du réseau de microtubule dans les cellules trachéales. En effet, nous avons mis en évidence un changement de l’organisation du centre de nucléation des microtubules. Au cours de la morphogenèse trachéale, les centrosomes sont inactivés et les microtubules sont nucléés depuis le domaine apical. La réalisation de ce projet a également permis de caractériser le rôle des microtubules au cours des étapes clefs associées au remodelage tissulaire : migration, intercalation et établissement de nouveaux contacts cellulaires.
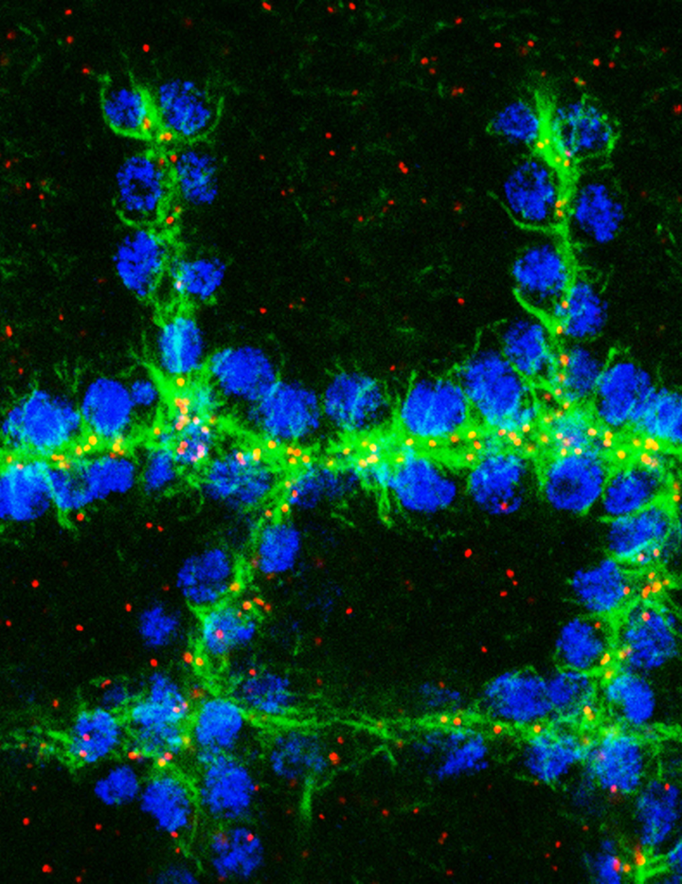
Organisation du réseau de microtubules (vert) et position des centrioles (rouge) dans les cellules trachéales (bleu) à stade 14
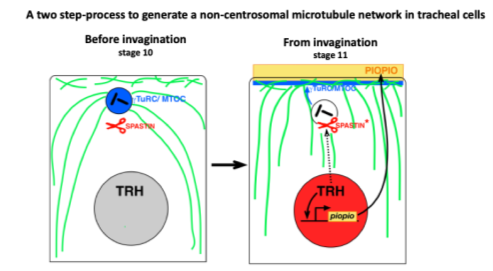
Caractérisation du cytosquelette d’active et son importance fonctionnelle dans l’intercalation cellulaire au cours de la morphogenèse du système trachéal
Nous cherchons à comprendre les mécanismes moléculaires et cellulaires par lesquels le réseau d’actine produit les forces qui permettent aux cellules de s’intercaler in vivo en 3D. Nous développons des outils innovants permettant de suivre in vivo suivre la dynamique de l’actine, de déterminer sa nature, son origine et sa contribution à l’intercalation cellulaire
Nous avons caractérisé un enrichissement et une stabilisation progressifs de l’actine au niveau des AJs pendant l’intercalation. La protéine adaptatrice du cytosquelette Girdin est un composant stable des AJ, où elle contribue à l’enrichissement en actine afin d’assurer une intercalation cellulaire correcte. L’enrichissement en actine commence au niveau des jonctions adhésives tri-cellulaires, où il présente un comportement « pulsatile », oscillant entre des phases de croissance et de décroissance.

Distribution du réseau d’actine (visualisé par Utrophine ::GFP) par rapport aux AJs (marquées par E-cadherin) dans les cellules trachéales au cours de la morphogenèse de la brache dorsale
- 2023-2025 V. BRODU, A. GUICHET and R. VIJENDRAVARMA, projet « GTube » , Émergence en recherche de l’Université Paris Cité », 34k€/ 2 ans
- 2010-2015 V. BRODU & A. GUICHET, Financement ARC « Subvention Libre », 450k€/ 3 ans et 2 ans d’extension
- 2009-2011: V. BRODU & A. GUICHET, Financement ARC « Subvention Fixe », 50k€/ 2 ans
- Equipe « Régulation de la dynamique du cytosquelette » dirigée par Antoine JEGOU et Guillaume ROMER-LEMONNE (Institut Jacques Monod, Paris).
- Equipe « Morphogenèse Cellulaire et Tissulaire » dirigée par Manos MAVRAKIS et Loïc LE GOFF (Institut Fresnel, Marseille).
- Equipe « Epithelial Morhogenesis»dirigée par Stefan LUSCHNIG ( Institute of Cell Biology and Physiology, Münster, Allemagne).
- Equipe « Mechanisms of morphogenesis and organogenesis » dirigée par Marta LLIMARGAS (Institute of Molecular Bology of Barcelona, Barcelone,Espagne).
Encadrement de thèse
- 2009-2014: Encadrement, en cotutelle avec A. GUICHET, de la Thèse de Doctorat de l’Université Denis Diderot-Paris VII de Pierre-Marie Le Droguen
- 2022-….: Encadrement, en cotutelle avec A. GUICHET, de la Thèse de Doctorat de Sandra Carvalho de l’Université Paris Cité
Encadrement de stage de Master 2 :
- 2009 : Encadrement de stage de Master 2 de Pierre-Marie LE DROGUEN dans le cadre du Magistère européen de Génétique de l’Université Denis Diderot-Paris VII
- 2017-2018 : Encadrement de stage de Master 2 de Sarah TAHERALY dans le cadre du Master Biologie Santé Ecologie option « Signalisation et Systèmes Intégrés en Biologie» de l’EPHE
- 2022 : Encadrement de stage de Master 2 de Sandra CARVALHO dans le cadre du Master Biologie et Biologue Cellulaire, Université Paris Cité
- 2023 : Encadrement de stage de Master 2 de Joanna AOUAD dans le cadre du Master Sciences du Vivant, spécialité Biotechnologies-Génie Cellulaire de l’ Université de Lorraine
Encadrement de stage de Master 1 :
- 2007 : Encadrement de stage de Master 1 de Sophie MURAT dans le cadre du Master Biologie Intégrative et Physiologie de l’Université Pierre et Marie Curie- PARIS VI
- 2012 : Encadrement de stage de Master 1 d’Antonin OUDAR dans le cadre du Master « Sciences et Santé » Spécialité « Biomolécules et Thérapies Expérimentales de l’Université XIII
- 2016 : Encadrement de stage de Master 1 de Flora CROZET dans le cadre du Master Biologie Moléculaire et Cellulaire de l’Université Pierre et Marie Curie PARIS VI
- 2017 : Encadrement de stage de Master 1 de Fanny MARTINI dans le cadre du Master Biologie Moléculaire et Cellulaire de l’Université Pierre et Marie Curie PARIS VI
- 2017 : Encadrement de stage de Master 1 de Sarah ZEROUALI-BLONDEAU dans le cadre du Master Biologie Santé option « Génomique, biologie moléculaire et cellulaire » de PARIS XI
- 2019 : Encadrement de stage libre de Fanny WODRASCKA, étudiante Master 1 du Master Biologie Moléculaire et Cellulaire, Université de Paris
- 2019 : Encadrement de stage de Master 1 de Mathilde CHOULY dans le cadre du Master Biologie Moléculaire et Cellulaire de l’Université Pierre et Marie Curie PARIS VI
- 2019-2020: Encadrement de stage de Master 1 de Axel GOSSEYE dans le cadre du Master Biologie Santé Ecologie option « Signalisation et Systèmes Intégrés en Biologie» de l’EPHE
- 2021: Encadrement de stage de Master 1 de Benjamin BOUZERAND dans le cadre du Master Biologie Moléculaire et Cellulaire, Université Paris Sorbonne
- 2023 : Encadrement de stage de Master 1 de Mathilde LE GARFF dans le cadre du Master Biologie Moléculaire et Cellulaire de l’Université de Rennes 1
Autres Encadrements :
- 2015 : Encadrement de stage de Licence 2 de Camille GUILLARD-SIRIEIX dans le cadre de la Licence Science du Vivant de l’Université Denis Diderot-Paris VII
- 2017 : Encadrement de stage de 2ème année de BTS Biotechnologies de Fanny WODRASCKA
- 2010- présent: Cours Magistraux en Master M2 «Aspects cellulaires du développement» de l’Université Paris Cité
- 2020- présent: Cours magistraux en Master M1 «Biologie du Développement» de l’ENS Université-PSL
Carvalho S., Laprise P., Guichet A., Brodu V*. (2025) Girdin controls the pace of 3D tracheal cell intercalation by coupling adherens junctions to the actin cytoskeleton in Drosophila, Development, in revision
Le Droguen P. M., Claret S., Guichet A*. and Brodu V*. (2015). Microtubule-dependent apical restriction of recycling endosomes sustains adherens junctions during morphogenesis of the Drosophila tracheal system. Development. 2015 142(2):363-74. * co-auteur correspondant
Brodu V*., Baffet A. D., Le Droguen P. M., Casanova J*. and Guichet A. (2010), A developmentally regulated two−step process generates a non−centrosomal microtubule network in Drosophila tracheal cells. Developmental Cell 18(5):790−801. * co-auteur correspondant
Brodu V. and Casanova J. (2006). The RhoGAP crossveinless-c links trachealess and EGFR signalling to cell shape remodelling in Drosophila tracheal invagination. Genes and Development, 20, 1817−1828
Brodu V., Elstob P.E. and Gould A.P. (2004) EGF Receptor Signaling is required for pulses of cell delamination from the Drosophila ectoderm. Developmental Cell, 7, 885-895
Brodu V., Elstob P.E. and Gould A.P. (2002) abdominal A specifies one cell identity in Drosophila by regulating one principal target gene. Development, 129, 2957-2963.
Elstob P.E., Brodu V. and Gould A.P. (2001) spalt-dependent switching between two cell fates that are induced by the Drosophila EGF receptor. Development, 128, 723-732.
Gould A.P., Elstob P.E. and Brodu V. (2001) Insect oenocytes: a system for studying cell-fate specification by Hox genes. Journal of Anatomy, 199, 25-33.
Brodu V., Mugat M., Fichelson P., Lepesant J.A. and Antoniewski C. (2001) A UAS site substitution approach to the in vivo dissection of promoters : interplay betwwen the GATAb activator and the AEF-1 repressor at a Drosophila Ecdysone Reponse Unit. Development, 128, 2593-2602.
Septembre 2008- présent : A l’initiation de la création et animatrice du «Club Cytoskeleton». Cette réunion mensuelle réunit différents laboratoires autour d’un thème de recherche commun, les cytosquelettes. Depuis 17 saisons, cette réunion rassemble 44 équipes, soit environ 320 personnes, réparties dans 18 instituts de recherche.
Novembre 2020, Novembre 2021, Juin 2023, Novembre 2024 et Novembre 2025 : coorganisatrice d’une journée complète «Paris Cytoskeleton Day» à l’Institut Jacques Monod, réunissant des intervenants nationaux et internationaux sur le thème du cytosquelette.

